SCN function
私たちのチームでは、マウスをモデルとして哺乳類の概日時計中枢である視交叉上核(suprachiasmatic nucleus, SCN)による全身の制御メカニズムを探求しています。
マウス脳内におけるGABA放出の概日リズム
γ-アミノ酪酸(Gamma Amino Butyric Acid, GABA)は、中枢神経系における重要な抑制性の神経伝達物質です。概日時計の中枢であるSCNにおいてもその大部分がGABA作動性の神経細胞で構成されています。
SCNの培養細胞にGABAの慢性投与を行うと細胞同士の時計が同期されることや(Leu C, 2000)、SCN特異的にGABAを欠損させたマウスにおいて自発行動量が低下し概日リズムが減衰することが報告されており(Ono D, 2019)、SCNにおいてGABAは概日時計の調節に重要な役割を持つことが示唆されています。しかし、その放出量の概日変動については未だに知られていません。
そこで本研究では、in vivoマイクロダイアリシス法を用いてマウスのSCN内におけるGABAの細胞外濃度を一定時間毎に計測・分析することで、概日リズムの有無を明らかにしていきます。他の神経伝達物質の放出リズムや神経発火リズム、SCN以外の脳部位のGABA放出リズムなどと比較することによって、SCNにおけるGABAの機能解明の一助となることを期待しています。
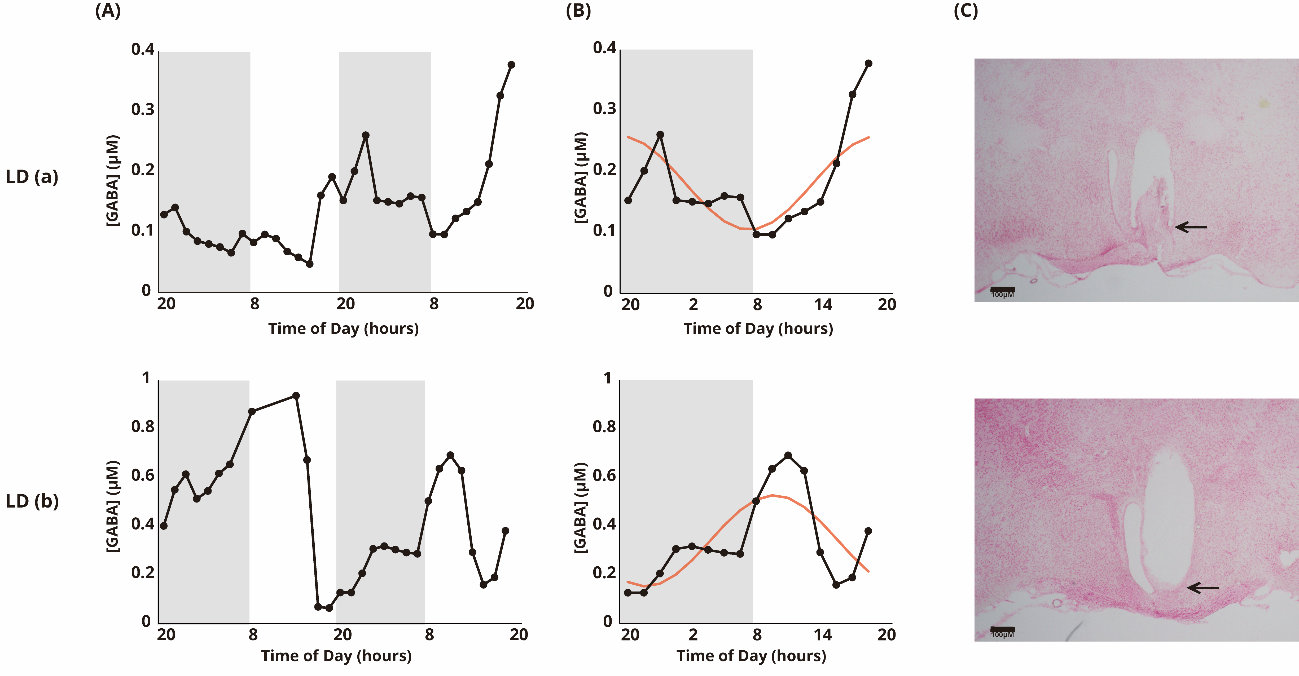
図1 マウスSCNにおけるGABA放出量の例
縦軸はGABAの濃度、横軸は時間を表す。
マウス脳内におけるモノアミン放出の概日リズム
モノアミンとはドーパミン、ノルアドレナリン、アドレナリン、セロトニン、ヒスタミンなどの神経伝達物質の総称であり、脳幹や視床下部において睡眠・覚醒状態に強く影響を与えることが知られています。
神経伝達物質はアミノ酸系とペプチド系、モノアミン系に分かれており、SCNにおいて主要なアミノ酸系神経伝達物質であるグルタミン酸やアスパラギン酸、ペプチド系であるバソプレシン(arginine vasopressin: AVP)や腸管作用性ペプチド(vasoactive intestinal polypeptide: VIP)の概日リズムは研究されています。しかし、モノアミンのSCNにおける概日時計への影響は未解明な部分が多く、前述したGABAと同様、SCNにおける放出量の概日リズムは知られていません。そこで本研究では、in vivoマイクロダイアリシス法を用いてマウスのSCN内におけるモノアミンの細胞外濃度を計測、分析していきます。GABAや他の神経伝達物質のリズムと比較することで、概日リズムの有無やSCNにおけるモノアミンの機能を検討していきます。

図2. マイクロダイアリシスシステム
左:飼育箱の全体像
中央:飼育箱内のマイクロダイアリシス配線とケージの様子
右:マイクロダイアリシスシステムに接続した状態のマウス
SCN-OVLT門脈系の機能解明
SCN-OVLT門脈は、脳の視床下部にある視交叉上核(SCN)とその先端から約1mm前方に位置する終板脈管器官(OVLT)をつなぐ門脈で、2021年、約90年ぶりにマウス脳内で発見された新しい脳内門脈です。現在この新門脈の機能的意義については全く明らかになっていません。そのため、この門脈の意義を明らかにすることが本研究の目的です。マイクロナイフによってドーム状にSCNをくり抜くSCN隔離術(iSCN)により門脈を切断し、再建前後のマウスの飲水や輪回し,性周期などの生体リズムを測定します。門脈は切断後再建し、その機能が回復することが知られていますが、神経線維を介した機能は一度切断されると回復しないことがわかっています。これらのことから、切断後の門脈の再建前後で行動リズムの変化を調べることで、この門脈の意義を検討します。
概日リズム調節における個々の視交叉上核ニューロンの役割
概日リズムの中枢である視交叉上核には約20,000個のニューロンが存在し、全身の行動・生理リズムを統合しています。時計遺伝子による転写翻訳ネガティブフィードバックループ(TTFL)によって、個々のニューロンのリズムが生成され、それらがネットワークを形成することで約24時間の概日リズムを生成しています。しかし、個々のニューロンが概日リズムの生成に対してどのような役割を果たしているのかはまだ明らかになっていません。
視交叉上核内のカルシウムイオンは、視交叉上核内のニューロンの活動に伴って増加します。そこで、Miniscopeという小型蛍光顕微鏡を用い、in vivoにてカルシウムイメージングを行い、視交叉上核の神経活動のリズムを検出し、記録・解析をすることで個々のニューロンの役割を解明する研究に取り組んでいます。
空間や時間において分解能が高いという特徴を持つMiniscopeを用いることで、生体内の環境をできるだけ崩さずに、マウスが生きた状態で視交叉上核内の個々のニューロンの神経活動を観察することができます。

図4. Miniscopeを取り付けたマウスの様子
雌性生殖機能における視交叉上核AVPニューロンの役割
1950年代初頭にEverettとSawyerが提案した排卵を誘発するLHサージを引き起こすためにcritical window(臨界時間枠)という時間帯(ZT9-11)に何らかの神経シグナルが必要であるということが分かっています。また、排卵に必要なGnRHサージを生む領域である視床下部の前腹側室周囲核(AVPV)のキスペプチンニューロンに、SCN内のAVPニューロンが投射していることが報告された。私たちはそれらの仮説に基づいて、光遺伝学的手法を用いて、特異的にAVP細胞をその時間帯に抑制することによって、AVP細胞の雌性生殖機能における役割を検討しています。
私たちはこれまでに、critical windowの時間帯にAVPニューロンを抑制すると、通常4日間で回復する性周期が延長することが観察されました。この結果から、LHサージをはじめとする雌性生殖機能にSCN内のAVPニューロンが重要な役割を果たしている可能性があることが示唆されました。現在は、同じ方法を用いてVIPニューロンの役割も検討しています。
概日時計中枢(SCN)における加齢の影響
生物が持つ概日リズムは、加齢に伴って変化が見られるようになることが分かっています。概日時計中枢であるSCNにおいては、加齢に伴って神経出力が弱まることが報告されていますが、in vitroの研究において老齢マウスのSCNリズム機構は正常に機能することが示され、in vivoにおける研究との間で矛盾が生じています。
そこで、本研究ではin vivoにおけるSCNリズム機構について調査することを目的に、時計遺伝子Per1のSCN内での発現リズムをin vivoで測定し、老齢マウスと若齢マウスで比較していきます。
加齢と時計遺伝子の関係性を解明することで、老化の予防や老化症状の改善の一助となることを期待しています。

図5. 光ファイバーを用いた自由行動マウスの生物発光測定の様子
ウルトラディアン温度変化による概日中枢時計安定化機構の解明
Per1欠損マウスでは、野生型と同様に輪回しリズムは夜に高く、日中に低くなっており、概日リズムを示します。また、Per1欠損マウスにおける生体内の多神経発火活動(MUA)リズムは概日リズムが認められます。(takasu et al.,2013)しかし、Per1⁻/⁻/PER2::LUCマウスのSCNスライスでは野生型と異なり、概日リズムを示しませんでした。(Pendergast et al.,2009) つまり、in vivo では概日リズムを示すのに対し、in vitroでは概日リズムを示しませんでした。
SCN周辺の脳温度を計測したところ、約2.5時間周期(ウルトラディアンリズム)で温度変化が観察されました。そこで、本研究では、in vivo とin vitro の矛盾はウルトラディアン温度リズムの違いであると考えており、SCNスライスに温度変化を与えると概日リズムが認められるのかを研究しています。

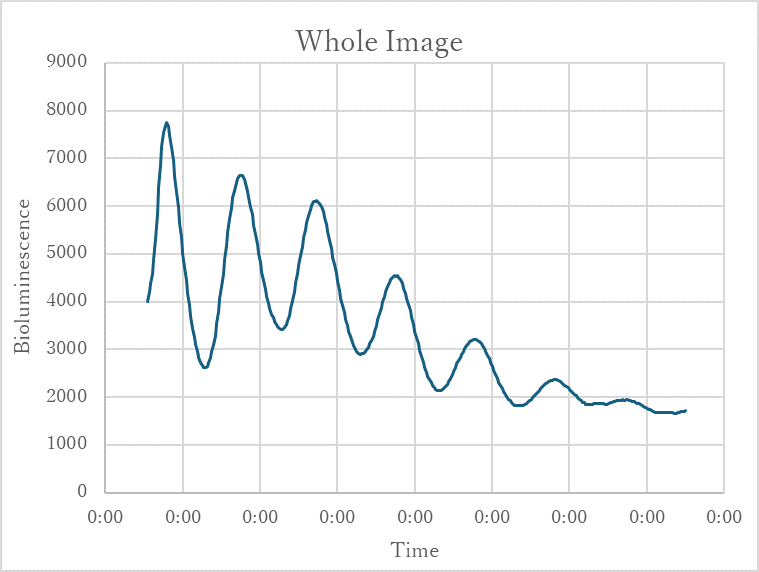
図6.野生型マウスのSCNスライスの発光(右)と1週間の発光リズム(左)
マウスの脳からSCNスライスを切り出した。このSCNスライスを暗い場所で、1週間撮影、記録をして発光リズムを観察すると、約24時間の概日リズムが認められる。
時計遺伝子欠損マウス(Pers TKO)における概日リズム発振機構の解明
現在、概日時計はPeriodをはじめとする時計遺伝子による転写と翻訳のフィードバックループによって生み出されると考えられています。哺乳類は3つのPeriod遺伝子(Per1, Per2, Per3)を持っていることが知られ、この3つをすべて欠失させたマウス(Pers TKOマウス)では概日時計は働かないと考えられています。しかし、概日行動リズムが消失したPers TKOマウスに、3時間の光刺激を与えると概日行動リズムが数日間現れることから、Per遺伝子を含む時計遺伝子のフィードバックループによらない概日時計機構があることが示唆されています。
そこで、本研究ではPers TKOマウスの新生児を用い、SCNのスライス培養および分散培養下での神経発火活動リズムを計測することで、このSCNにおける既知の時計遺伝子のフィードバックループによらない概日時計機構の存在を検討します。

図7. SCN組織とその神経発火を記録するための複数の電極(中央)







