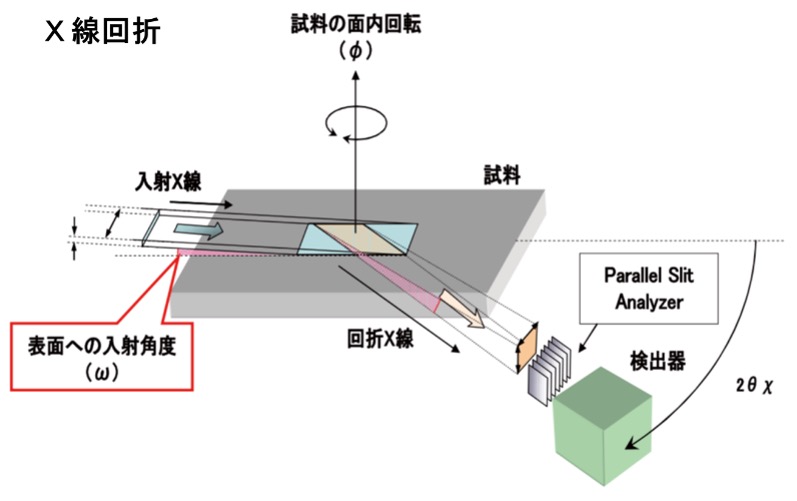
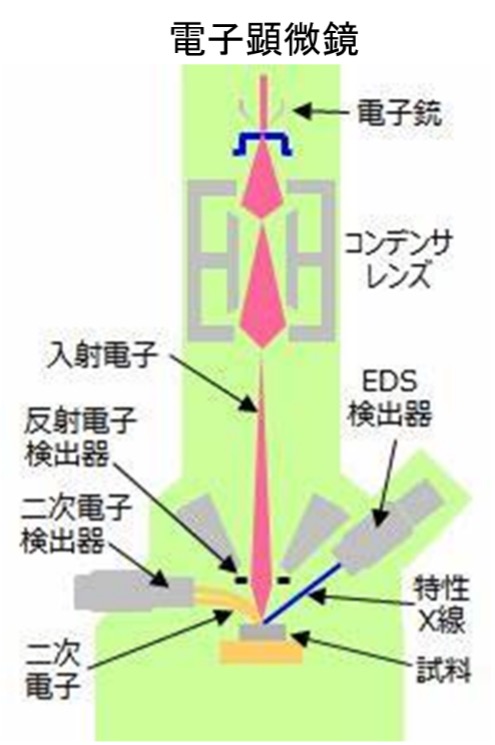
化学の泉
2025年10月7日
「化学の泉」投稿文(その45)/豆知識(はじまりシリーズ)
【金属結合の解明の歴史】
世の中の物質は大ざっぱに3つに分けられます。「金属」「イオン性物質」「分子性物質」です。
1811年にイタリア人の物理学者で化学者のアメデオ・アヴォガドロ(1776~1856年)が「原子が特定な数だけ引力で結合して一個の分子を形成している」と提唱してから、分子の概念が定着し、すべての物質が、原子が集まってできた分子からできていると考えられるようになりました。しかし、1897年にイギリス人物理学者ジョゼフ・ジョン・トムソン(1856~1940年)によって電子が発見され、1900年にドイツ人物理学者マックス・プランク(1858~1947年)が量子論を発表したことで、物理学と化学の新時代が幕を開けました。その後「金属内で電子が原子間を自由に移動することで電流が生じる」という画期的な自由電子理論が確立され、金属や塩化ナトリウムなどは分子からできていないことが分かりました。
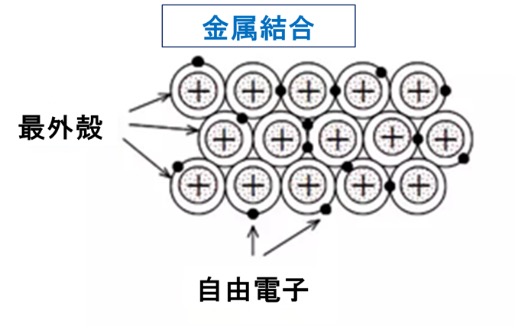
金属は、金属原子が電子を放して陽イオンになって、陽イオンの集合体の間を所属する原子のない自由に動ける自由電子がウロウロしています。金属を原子の化学結合で定義する場合、特有の金属結合で説明されます。金属結合は、カチオン化した金属元素が規則正しく並び、その間を自由電子が動き回りながら、これらの間に働くクーロン力(静電気力、静電引力)で結び付けられている結合を指し、常温下でこのような結合状態にある物質を金属と定義しています。
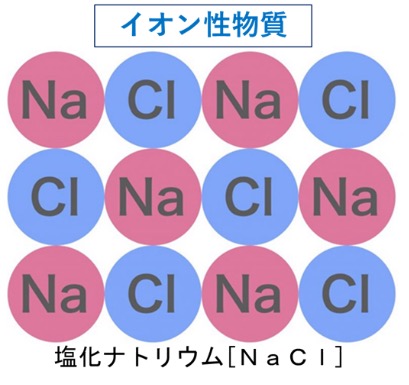
イオン性物質は、陽イオンと陰イオンが静電気的な力で結びついてできていて、塩化ナトリウム、水酸化ナトリウム、硫酸ナトリウム、炭酸カルシウムなどがあります。クーロン力は、単純に正電荷をもつ陽イオンと負電荷をもつ陰イオンが引き付けあっているだけですから陽イオンの周りには陰イオンが、陰イオンの周りには陽イオンがどんどん集まって大きなかたまりを作ります。このようにしてイオンがクーロン力によって結びついて生じる物質をイオン性物質と言います。
イオン性物質は基本的にNaCl、CaCl2、CaOなど「金属元素+非金属元素」の組み合わせでできている物質ですが、NH4Clのようにアンモニウムイオンが含まれる化合物は、非金属元素のみで生じる物質でありながらイオン性物質です。NH4+ (アンモニウムイオン)とCl-(塩素イオン)の間に生じるイオン結合によって集合している物質です。
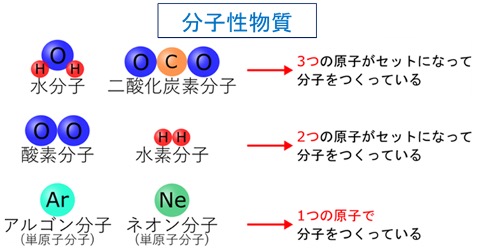
分子性物質は、原子が結びついた分子からできています。分子は、ふつう複数の原子が結びついてできていますが、ヘリウムのような貴ガスは原子が1個の単原子分子です。分子性物質には、水素、酸素などの気体、エタノールなどの液体、砂糖の主成分であるショ糖などの固体があります。
分子性物質とは、電荷を持たない状態の分子からなる物質です。分子性物質は、原子、イオン、分子の間に働く分子間力である「ファンデルワールス力」により集合しているので、分子量が増大するにつれて融点や沸点が増大します。それに加えて水素結合を有するものは、さらに融点や沸点が高くなります。
世の中の物質は、「金属」「イオン性物質」「分子性物質」の3つに、「無機高分子」と「有機高分子」を加えて5つに分ける場合もあります。
無機高分子は、炭素原子でできたダイヤモンド、二酸化ケイ素などがあり、その固まりは、1つの巨大な分子ともいえます。
有機高分子は、タンパク質、セルロース、ゴム、合成繊維やプラスチックの材料のナイロン、ポリエチレン、ポリ塩化ビニルなどで、炭素原子を骨組みの中心とする巨大な分子です。
まず、金属原子と非金属原子に注目し、物質がどんな元素からできているかがわかると、「金属」「イオン性物質」「分子性物質」の三大物質のどのグループかが大まかに理解できます。金属は金属元素からできていて金属結晶です。イオン性物質は金属元素と非金属元素が結びついてできています。金属元素は陽イオンになり、非金属元素は陰イオンになります。陽イオンと陰イオンが電気的な力で結びついていて、固体はイオン結晶です。分子性物質は非金属の原子どうしが結びついてできている分子からなり、固体は分子結晶です。
19世紀、熱力学第1法則・第2法則の定式化やエントロピーの概念を導入したドイツ人理論物理学者ルドルフ・クラウジウス(1822~1888年)は、金属の熱伝導性に着目し、金属が熱を伝える際に、分子や原子がどのように関与しているのかを理解しようとしました。クラウジウスの研究は、金属内部のエネルギーの移動に重要なヒントを提供し、後の自由電子の役割を解明する基礎となりました。クラウジウスの熱力学に関する研究は、物理学の根本的な理論に革命をもたらし、熱とエネルギーの関係を正確に示しました。
19世紀、科学者たちは電気と金属の関係に頭を悩ませていました。なぜ金属は他の物質に比べて電気をよく通すのか? この問いに挑んだのがドイツ人物理学者ゲオルク・ジーモン・オーム(1789~1854年)でした。オームは金属導体の中を電流が流れる仕組みを数学的に分析し、1826年に「オームの法則」を発表しました。この法則は、電圧・電流・抵抗の関係を示すもので、金属が電気を通す秘密に迫る重要な一歩でした。しかし、「オームの法則」が発表された当時は、まだ電子という概念が確立されておらず、自由電子の存在が解明されるのはこれからのことでした。
その後、1897年にトムソンによって電子が発見され、1900年にプランクが量子論を発表し、金属内で自由に動く「自由電子」というアイデアが生まれました。そして、自由電子理論は、19世紀末から20世紀初頭にかけて発展しました。
1853年にドイツ人物理学者グスタフ・ヴィーデマン(1826~1899年)とルドルフ・フランツ(生没年不詳)が金属の電気伝導に関する経験則において、金属が異なっても温度が同じであれば金属の熱伝導度率(K)と電気伝導度率(σ)の比の値「K/σ」がほぼ同じであると報告し、1872年にデンマーク人の数学者で物理学者のルードヴィヒ・ローレンツ(1829~1891年)がこの比の値「K/σ」が温度に比例することを発見したことで、この物理法則は「ヴィーデマン・フランツの法則」と名づけられました。
1900年にドイツ人物理学者パウル・ドルーデ(1863~1906年)によって「電子がどう流れるのか?」という問題が提唱され、電気伝導に関する自由電子モデルによる解析で「ヴィーデマン・フランツの法則」を説明するのに成功しました。最初、自由電子理論は、金属の価電子が自由電子のガスとして存在すると考え、金属の電気伝導や熱伝導を説明するために使用されました。特に、自由電子理論は、金属内で電子が原子間を自由に移動することで電流が生じるという画期的な考え方でした。この理論は、金属が電気を伝えるメカニズムを明確にし、電気工学や材料科学の発展に大きな影響を与えました。
ところで、電気だけでなく、熱もまた自由電子によって伝わります。19世紀後半、古典電磁気学を確立したイギリス人理論物理学者ジェームズ・クラーク・マクスウェル(1831~1879年)や熱力学第2法則を統計的に説明したオーストリア人物理学者ルートヴィッヒ・ボルツマン(1844~1906年)の研究が進み、金属中の熱伝導のメカニズムが明らかになりました。自由電子が金属内で動き回ることで、熱エネルギーが効率的に伝達されることにより、金属が電気だけでなく、熱にも優れた伝導体である理由が解明されました。この発見は、日常生活における金属製品の設計や産業技術に不可欠な知識となっています。
自由電子理論が確立されると、電気工学は飛躍的に発展し、発電所や送電システム、電化製品の効率が格段に向上しました。特に、アメリカ人発明家トーマス・アルバ・エジソン(1847~1931年)やセルビア系アメリカ人発明家ニコラ・テスラ(1856~1943年)の発明は、自由電子理論を応用し、電気の供給と利用を劇的に変えました。金属の中を自由に動き回る電子たちが、現代の電気技術の基盤を築いたといっても過言ではありません。自由電子の発見は、まさに産業革命のエネルギー源でした。
19世紀のもう一人の重要な人物は、イギリス人の化学者で物理学者のマイケル・ファラデー(1791~1867年)でした。彼は、電気分解を通じて電気と化学反応の関係を明らかにしました。1830年代、ファラデーは金属イオンが電場の影響で動くことを発見し、これが後の金属結合の理解に繋がりました。ファラデーの法則は、金属内での電気の流れがどのように物質に影響を与えるかを示し、電気化学や電池技術の発展に多大な貢献を果たし、ファラデーの研究は金属の電気的性質の理解に革命をもたらしました。
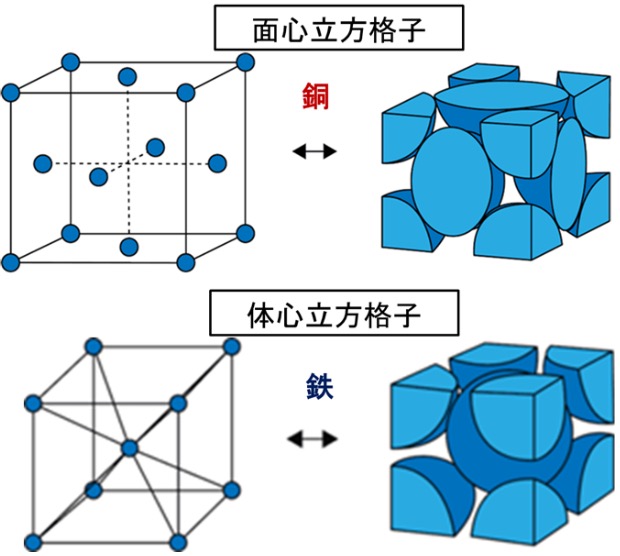
金属をミクロの視点で見ると、原子が規則正しく並んだ「結晶構造」を持っています。この整然とした配列が、金属の強度や特性に大きな影響を与えます。例えば、鉄やアルミニウムの結晶構造は、金属同士が密に結びつくため、驚くほどの強度と耐久性を持っています。この結晶構造の中では、原子が互いに強く引き合っており、そのために金属はたやすく崩れません。まさに、自然が作り出した「原子のパズル」と言えます。
金属によってその結晶構造は異なり、これが各金属の異なる特性を生み出します。例えば、銅は「面心立方格子」と呼ばれる柔らかくて伸びやすい構造を持ちます。一方、鉄は「体心立方格子」という非常に硬い別の構造を持ちます。これらの違いは、結晶内での原子の並び方によって決まります。また、温度や圧力によって結晶構造が変わる場合もあり、この変化が金属の性質に多様性をもたらしています。材料科学者たちはこの結晶構造を巧みに操って、最適な材料を開発しています。
結晶構造は完璧に見えますが、実際には「欠陥」が存在することが多く、驚くべきことに、これらの欠陥が金属の性質に重要な役割を果たしています。例えば、結晶内の欠陥があることで、金属は簡単に変形し、圧力に耐えられるようになります。逆に、欠陥が少ないと金属は硬くなり、もろくなることもあります。こうした欠陥をうまく利用することで、材料の性質を調整する技術が進化し、産業や製造分野で広く応用されています。
結晶構造の理解は、現代の工業技術に革命をもたらしました。航空機や自動車の軽量化、建築用の強力な鉄骨、スマートフォンの高性能な部品はすべて、この結晶の科学に基づいています。合金技術によって、異なる結晶構造を持つ金属を組み合わせることで、より強く、軽く、そして耐久性の高い材料が作られています。結晶構造の理解が進むことで、未来の技術革新がさらに広がり、私たちの生活がより快適で豊かになることは間違いありません。
20世紀初頭、物理学は全く新しい視点に立ちました。プランクやユダヤ系ドイツ人理論物理学者アルベルト・アインシュタイン(1879~1955年)らが提唱した量子力学の登場によって、原子や電子のふるまいが再定義されました。この新しい理論は、従来のニュートン物理学では説明できなかった現象を解き明かす鍵となりました。金属内での電子の運動も、この量子力学の法則に基づいて再解釈され、金属結合の仕組みがより詳細に説明できるようになりました。まさに、物質の最小単位である素粒子の一つである電子の「ミクロの冒険」が始まった瞬間でした。
量子力学の発展により、1920年代後半にユダヤ系スイス人物理学者フェリックス・ブロッホ(1905~1983年)、ドイツ生まれのイギリス人物理学者ルドルフ・パイエルス(1907~1995年)、フランス人物理学者レオン・ブリルアン(1889~1969年)らによって確立された電子が金属内をどのように動き回るかを説明する「バンド理論」が生まれました。バンド理論によれば、金属内の電子は「エネルギーバンド」という特定の範囲内で自由に動くことができます。これは、自由電子の存在をさらに細かく説明するものであり、なぜ金属が電気を非常に良く通すのか、逆に絶縁体はなぜ通さないのかを明確にしました。バンド理論は、現代のエレクトロニクスや半導体技術の基礎となる重要な理論です。
バンド理論の魅力は、金属を「導体」や「絶縁体」に分類できる点にあります。金属は、エネルギーバンドの中に「伝導帯」と呼ばれる領域が存在し、ここに電子が自由に移動できるスペースがあるため、電気を通しやすく、一方、絶縁体では、この伝導帯に到達するためのエネルギーが非常に高く、電子が自由に動けないため、電気を通しません。この理論は、科学者が材料の性質を予測し、特定の機能に応じた新しい材料を設計するための強力なツールとなりました。
バンド理論は、科学の世界だけでなく技術にも革新をもたらし、この理論のおかげで、私たちは現代のスマートフォンやコンピュータの半導体、さらにはLEDや太陽電池のような先進的な技術を手にすることができるようになりました。これらの技術は、すべてバンド理論によって理解され、進化してきました。さらに、新素材の開発においても、バンド理論は欠かせない要素となっています。まさに、金属結合の理解が私たちの未来を形作る道しるべとなっています。
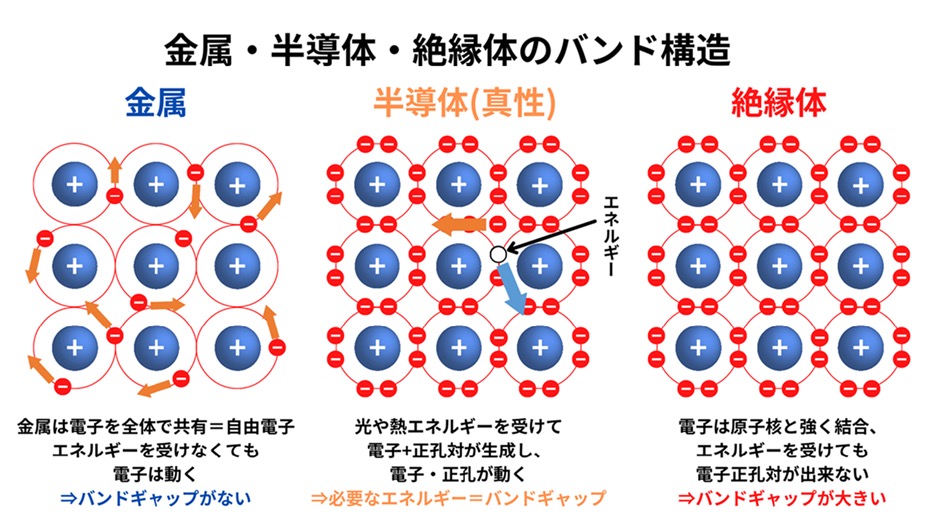
金属は電気を簡単に通す一方、半導体は必要な条件がそろわないと電気を通しません。この違いを理解するには、金属と半導体のバンド理論が鍵となります。金属では、自由電子が「伝導帯」と呼ばれるエネルギー領域を自由に動き回ります。しかし、半導体では、温度や不純物の影響で電子が伝導帯に移ることで、電気を流せる状態になります。この性質は、私たちの日常生活で欠かせないコンピュータやスマートフォンの基本構造を支えています。
20世紀の半ば、シリコンという元素が技術の革命を引き起こしました。シリコンは半導体材料として理想的な性質を持っており、これがトランジスタやマイクロチップの開発を可能にしました。シリコンの結晶構造は、電気を通す能力を微細に制御できるため、コンピュータの計算処理やメモリ技術の基盤となりました。まさにシリコンの発見とその応用は、現代の電子機器の進化を支える大きな転換点であり、「シリコンバレー」という言葉にもその重要性が反映されています。
金属と半導体は、それぞれの特性を活かして協力し合う技術が数多くあります。例えば、トランジスタでは、金属が電気を供給し、半導体がその流れを調整しています。この協力関係によって、私たちは高速で正確な計算が可能なコンピュータやスマートフォンを手にすることができました。さらに、LEDや太陽電池といったエネルギー効率の高い技術も、金属と半導体の相互作用により実現しています。
半導体技術は今後も進化を続け、さらなる未来を形作るでしょう。特に量子コンピュータの研究では、金属と半導体の物理的性質を利用して、現在のコンピュータでは考えられないほどの高速処理を目指しています。また、新しい材料の開発により、エネルギー効率が格段に向上し、環境に優しい技術が生まれることが期待されています。半導体と金属の融合は、これからの世界を変える可能性を秘めています。
文献:
ウィキペディア・フリー百科事典
「金属」「イオン性物質」「分子性物質」「アメデオ・アヴォガドロ」「ジョゼフ・ジョン・トムソン」
「マックス・プランク」「無機高分子」「有機高分子」「ゲオルク・ジーモン・オーム」
「グスタフ・ヴィーデマン」「ルードヴィヒ・ローレンツ」「ヴィーデマン・フランツ則」
「パウル・ドルーデ」「自由電子理論」「ジェームズ・クラーク・マクスウェル」
「ルートヴィッヒ・ボルツマン」「トーマス・アルバ・エジソン」「ニコラ・テスラ」
「ルドルフ・クラウジウス」「ゲオルク・ジーモン・オーム」「マイケル・ファラデー」
「面心立方格子」「体心立方格子」「マックス・プランク」「アルベルト・アインシュタイン」
「フェリックス・ブロッホ」「ルドルフ・パイエルス」「レオン・ブリルアン」「バンド理論」
2025年9月1日
「化学の泉」投稿文(その44)/豆知識(はじまりシリーズ)
【合金の歴史】
合金とは、単一の金属元素からなる純金属に対して、複数の金属元素あるいは金属元素と非金属元素から成る、電気伝導性、熱伝導性、金属光沢、展性、延性などの金属の性質を持つものをいいます。純金属に他の元素を添加し組成を変えることで、機械的強度、融点、磁性、耐食性、自己潤滑性といった、材料としての性能を向上させた合金が様々な用途に利用されています。
一言に合金といっても様々な状態があり、完全に溶け込んでいる「固溶体」、結晶レベルでは成分の金属がそれぞれ独立している「共晶」、原子のレベルで一定の割合で結合した「金属間化合物」などがあります。合金の作製方法には、単純に数種類の金属を溶かして混ぜ合わせる方法や、原料金属の粉末を混合して融点以下で加熱する焼結法、化学的手法による合金メッキ、粉砕機の1種で、セラミックなどの硬質のボールと、材料の粉を円筒形の容器にいれて回転させることによって、材料をすりつぶして微細な粉末を作るボールミル装置を使用して機械的に混合するメカニカルアロイングなどがあります。ただし、全ての金属が任意の割合で合金となるわけではなく、合金を得られる組成の範囲については、物理的・化学的に制限(あるいは最適点)が存在します。
合金はその構造や成形方法によってさまざまな分類が可能です。それぞれの分類には独自の特徴と応用範囲があり、目的や用途に応じて最適な合金が選ばれます。
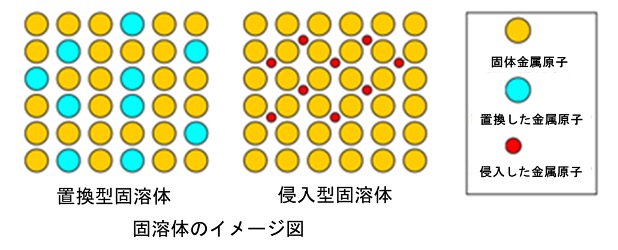
合金は、構成元素の原子がどのように金属格子に配置されるかによって、大きく「置換型合金」と「侵入型合金」に分類されます。これらの分類は、構成原子の大きさや性質の違いに基づいています。置換型合金は、主成分となる金属の原子が他の元素の原子に置き換わることで形成されています。この場合、置換される原子と置換する原子の大きさが比較的似ていることが重要です。例えば、銅と亜鉛を混ぜて作られる真鍮や、銅とスズを組み合わせた青銅が置換型合金の代表例です。これらの合金は、金属原子間の規則的な配置を維持しながら、強度や耐久性が向上する特性を持ちます。真鍮は硬さと加工性を両立させており、楽器や装飾品に使用されています。一方、青銅は耐摩耗性が高く、古代の武器や工具に広く用いられました。
侵入型合金は、主成分の金属原子の間隙(空隙)に、より小さな原子が入り込むことで形成されます。この場合、小さな原子は格子内で固定され、金属全体の硬度や強度を向上させます。鋼鉄は典型的な侵入型合金であり、鉄の格子構造に炭素原子が入り込むことで強度が増します。また、鋼鉄は熱処理により性質を調整することができるため、構造材料から工具まで幅広い用途に対応しています。
合金は、その内部構造が単一の相からなるか、複数の相で構成されるかによって、「均質合金」か「異質合金」に分類されます。これらは、合金が冷却される際に構成元素がどのように結晶化するかに依存します。
均質合金は、単一相で構成される合金で、全体が均一な結晶構造を持っています。これにより、物理的特性が一貫しており、特定の用途に適しています。例えば、真鍮や青銅は均質合金の代表例であり、その一様な性質により加工性や耐食性が求められる製品に利用されます。均質合金は一般に、特定の温度範囲で融点が安定しており、融解と固化の制御が容易です。
異質合金は、複数の相で構成される合金で、異なる結晶構造が共存します。これにより、特定の特性が強調され、特に強度や耐久性が求められる用途に適しています。鋼鉄やステンレス鋼は異質合金の一例であり、複数の相が存在することで機械的特性が向上しています。異質合金は通常、冷却速度や熱処理条件によってその微細構造が制御されます。
合金はその生成方法によって、「自然発生合金」と「人工合金」に分類されます。自然発生合金は自然界で形成されるものであり、人工合金は、人為的なプロセスを通じて作られるものです。
自然発生合金は、自然界で元素が混ざり合うことによって形成されます。エレクトラム(琥珀金)は自然発生合金の代表例であり、金と銀の混合物として古代文明で貨幣や装飾品に利用されました。また、隕石に含まれる鉄とニッケルの合金も自然発生合金の一種です。これらの合金は、古代の道具や武器に使用され、人類の技術発展に寄与しました。
人工合金は、人為的に設計され、特定の性能を発揮するように作られます。1910年代前半頃に発明・実用化されたステンレス鋼は鉄にクロムやニッケルを添加した人工合金で、耐腐食性が非常に高い特性を持っています。また、1901年にドイツ人冶金学者アルフレート・ヴィルム(1869~1937年)が発明したジュラルミンはアルミニウムに銅、マグネシウム、マンガンを加えた合金で、航空機の軽量構造材料として広く利用されています。日本では、1936年に住友伸銅所が超々ジュラルミンを開発し零式戦闘機の構造材料に使用されました。これらの人工合金は、現代の科学技術の進歩によってその性能がさらに向上し、多岐にわたる産業分野で活用されています。
参考までに、「溶解(ようかい)」と「融解(ゆうかい)」は似ている化学現象ですが、まったく別物です。「溶解」とは、ある気体・液体・固体が、他の液体や固体に溶け込んで等しく混ざることを言います。一方、「融解」とは、結晶構造をもつ固体が、自ら溶けて液体に変わる現象を指します。そこで、溶解と融解の使い分けには注意が必要です。
合金の製造方法は多岐にわたり、目的や用途に応じて最適な手法が選択されています。融解法や固体状態での技術、さらには熱処理技術を組み合わせることで、現代の多様なニーズに応える高性能な合金が生み出されています。
融解法は、基礎金属を高温で融解し、他の物質(溶質)を溶解させることで合金を作る基本的な方法です。この方法は、金属が液体状態になる温度(融点)を利用し、さまざまな元素を混ぜ合わせることで新しい特性を得ることが可能です。基礎金属を融解する際には、その純度と加熱温度が重要な要素となります。例えば、鉄を融解して炭素やクロムを溶解することで鋼やステンレス鋼が製造されます。また、アルミニウム合金の場合、アルミニウムを融解した後に銅やマグネシウムを添加し、軽量で高強度な材料が作られます。融解法では、溶解した元素が均一に分散するように攪拌を行い、冷却時に均質な合金を成形することが求められます。
固体状態での合金化は、融解法とは異なり、金属が固体のまま他の元素と反応して合金を成形する方法です。この方法は、比較的低い温度で処理できるため、特定の用途や目的に適しています。
パターン鍛造は、異なる金属を層状に重ねて加熱し、叩いて結合させる技術です。この方法は、古代の刀剣や装飾品の製造に利用され、強度と美観を両立させる技術として知られています。特に日本刀の製造では、軟鉄と硬鉄を交互に積層することで、しなやかさと切れ味を兼ね備えた刃が作られました。
セメンテーションは、固体状態の鉄に炭素を浸透させる技術で、炭素鋼の製造に使用されます。鉄を炭素を含む物質(木炭など)とともに高熱で処理し、炭素を表面に浸透させることで、硬度や耐摩耗性が向上します。この技術は、近代的な浸炭処理の原型となり、浸炭焼入れ、浸炭焼戻しなどの熱処理技術として多くの産業で応用されています。
熱処理は、合金の特性をさらに向上させるための重要なプロセスであり、材料の硬度、強度、靭性を調整するために用いられます。熱処理には、「焼きなまし」「急冷」「析出硬化」など、さまざまな手法があります。
焼きなましは、金属を高温に加熱し、ゆっくりと冷却することで内部応力を取り除き、柔らかくする方法です。このプロセスにより、加工性が向上し、脆性が低下します。鋼やアルミニウム合金など、多くの金属材料で利用される一般的な方法です。
急冷は、金属を高温に加熱した後、急激に冷却することで硬度を高める手法です。例えば、1891年にドイツ人冶金学者アドルフ・マルテンス(1850~1914年)により発見された「マルテンサイト」は、鋼を水や油で急冷すると形成されます。マルテンサイトは、体心正方格子の鉄の結晶中に炭素が侵入した固溶体で、鉄鋼材料の組織の中で最も硬く脆い組織です。急冷は工具や刃物の製造において重要なプロセスです。
析出硬化は、合金中に過飽和に固溶した化学成分が析出して、組織中に微小な粒子を分散・形成させることで、材料の強度・硬さが向上します。合金を高温で均質化した後、徐々に冷却して固体中に微細な析出物を成形させます。このプロセスにより、合金内部に形成される微細な構造が強度を向上させます。アルミニウム合金やニッケル基超合金などで広く利用され、航空機やタービンエンジンの部品に適用されています。
合金の歴史は、人類が自然界の金属を加工し、それを組み合わせる技術を展開させてきた過程を反映しています。古代から現代に至るまで、合金の展開は文明の進化に直結し、多くの技術革新を支えてきました。
初期の合金の一つは青銅です。紀元前3000年頃、古代メソポタミア文明であるシュメール文明で発明されたと言われています。メソポタミアやエジプトで銅とスズを組み合わせた青銅が製造されました。青銅は純粋な銅よりも硬く、耐久性が高いため、武器や道具、彫刻などに広く使用されました。この時代は「青銅器時代(紀元前3000年頃~紀元前1200年頃)」と呼ばれ、合金の使用が文明の発展を加速させた時期として知られています。一方、青銅より以前に自然発生合金として発見されたと言われる真鍮は、銅と亜鉛の合金として登場し、装飾品や硬貨、さらには楽器の製造に利用されました。真鍮は青銅と異なり、亜鉛の含有量を調整することで、硬度や光沢を調節できるため、多様な用途に適応されました。また、鉄隕石は自然発生的な合金として古代から珍重されていました。鉄隕石に含まれる鉄とニッケルは非常に硬く、工具や武器として利用されました。隕石由来の鉄は加工が難しい一方で、非常に貴重であり、古代の王族や祭礼用の品としても用いられました。
古代の冶金技術は、金属を加工し合金を作る上で重要な役割を果たしました。冶金とは、鉱石から金属を抽出し、それを加工して利用可能な形にする技術です。紀元前2500年頃には、銅鉱石を1000℃以上の高温(1084℃)で融解することで純粋な銅を取り出す技術が確立されました。さらに、銅にスズを加えることで青銅を作る技術が発展し、硬度や耐久性の向上が実現しました。
鋳造技術もまた、古代における合金加工の重要な要素でした。鋳造とは、金属を熱して叩き、形を整える技術です。この技術により、青銅の剣や鉄器が製造され、農具や武器として広く普及しました。また、金属表面の装飾や強化を目的とした鋳造技術も展開し、金属加工の芸術性が向上しました。
近代(18世紀末期~19世紀前半)に入ると、合金技術はさらに大きな進化を遂げました。その中でも特記すべきは、ステンレス鋼、高速度鋼、そして超硬合金や超耐熱合金の開発です。
ステンレス鋼は、1913年にイギリス人製鋼技術者ハリー・ブレアリー(1871~1948年)が発明し実用化しました。鉄にクロムを添加することで耐腐食性を持たせたこの合金は、錆びにくく、高い耐久性を持っています。これにより、ステンレス鋼はキッチン用品や建築材料、医療機器など、さまざまな分野で広く採用されるようになりました。
高速度鋼は、1868年にイギリス人金属工学者ロバート・フォレスター・マシェット(生没年不詳)が発明したマシェット鋼がその原型とされています。タングステンやモリブデンを鉄に添加することで生まれました。この合金は、高温下でも硬度を保つことができ、切削工具や機械部品として非常に有用です。また、鉄道や航空機産業の発展にも大きく寄与しました。
超硬合金は、1923年にドイツのオスラム社の技術者カール・シュローター(生没年不詳)が発明したダイヤモンドに次ぐ硬さを持ち、耐摩耗性や高い弾性率を兼ね備えた合金で、ニッケルやコバルトを基盤として、耐熱性や耐腐食性を極限まで高めた合金です。超耐熱合金は、1932年にアメルカのインターナショナル・ニッケル・カンパニー社が開発したインコネルがその原型とされています。ニッケルとクロムを主成分とする耐熱性と耐酸化性に優れた合金です。これらはジェットエンジンやガスタービンなど、高温での使用が求められる環境で不可欠な素材です。超硬合金や超耐熱合金の開発は、航空宇宙産業や発電分野の技術進歩を大きく支えました。
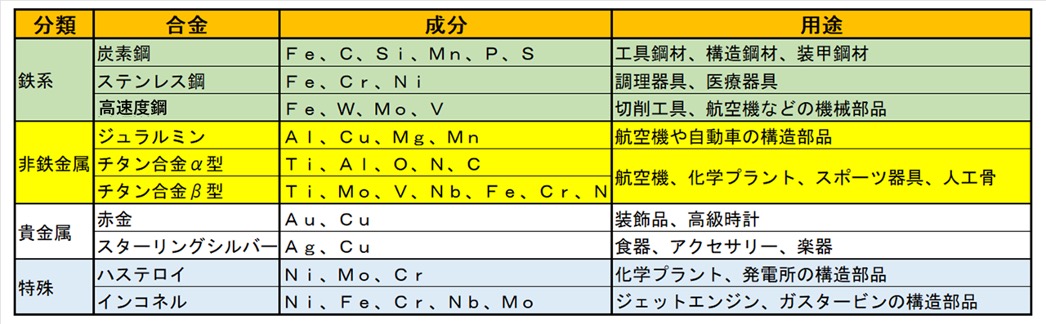
合金は、その多様な組成と特性により、「鉄系合金」、「非鉄金属合金」、「貴金属合金」、「特殊合金」に分類され、さまざま用途で利用されています。
鉄系合金は、鉄を基礎金属とする合金で、建築、工業、輸送などの幅広い分野で不可欠な存在です。炭素鋼は、鉄に炭素を添加した合金で、含まれる炭素量に応じて性質が異なります。ステンレス鋼は、鉄にクロムやニッケルを加えた耐腐食性の高い合金です。高速度鋼は、タングステン、モリブデン、バナジウムなどを添加した合金で、高温下でも硬度を保つ特性を持っています。
非鉄金属合金は、鉄以外の金属を基礎とした合金で、軽量性や耐食性が求められる用途で広く利用されています。アルミニウム合金は、軽量で加工性に優れた合金で、ジュラルミン(アルミニウムに銅、マグネシウム、マンガンを添加)は、航空機や自動車の構造部品に利用されます。チタン合金は、軽量で高強度、さらに耐食性がすぐれているため、発電プラント、航空宇宙産業や医療機器に利用されています。
貴金属合金は、金や銀などの貴金属を基礎とした合金で、美しさや耐久性を兼ね備えています。赤金は、金に銅を混ぜた合金で、赤みがかった独特の色合いを持ち、その美しさから、装飾品や高級時計に広く利用されています。スターリングシルバーは、銀に銅を加えた合金で、純銀よりも強度が高く、実用性に優れ、食器、アクセサリー、楽器など、多様な製品に使用され、銀特有の光沢が高級感を与えます。
特殊合金は、特定の条件下で高い性能を発揮するよう設計された合金で、主に過酷な環境で使用されます。超硬合金は、硬質の金属炭化物の粉末を焼結して作られる合金です。例えば、炭化タングステン(タングステン・カーバイド)と結合剤(バインダ)であるコバルト(Co)とを混合して焼結したものが代表的な超硬合金です。ハステロイは、ニッケルを基礎とした耐腐食性に優れた合金で、高温下や腐食性の強い環境において信頼性が高く、化学プラントや発電所で使用されます。超耐熱合金は、高い耐熱性を持つニッケル(Ni)やコバルト(Co)を主成分として、それぞれの必要特性にあわせて添加物を調整します。例えば、インコネルは、代表的な超耐熱合金でジェットエンジンやガスタービンなど、高温での使用が求められる部品に利用されています。
このように、合金の歴史は人類の技術の進化と深く結びついています。初期の青銅や真鍮から、現代の超硬合金や超耐熱合金に至るまで、合金技術は常に社会の発展に寄与してきました。今後も、新しい合金の開発が多くの産業における技術革新を牽引すると期待されています。
文献:
ウィキペディア・フリー百科事典
「合金」「固溶体」「共晶」「金属間化合物」「焼結法」「メカニカルアロイング」「置換型合金」「侵入型合金」
「真鍮」「青銅」「鋼鉄」「均質合金」「異質合金」「ステンレス鋼」「自然発生合金」「人工合金」
「エレクトラム」「アルフレート・ヴィルム」「ジュラルミン」「融解法」「パターン鍛造」「浸炭処理」
「セメンテーション」「焼きなまし」「急冷」「析出硬化」「アドルフ・マルテンス」「マルテンサイト」
「アルミニウム合金」「ニッケル基超合金」「古代メソポタミア文明」「シュメール文明」「青銅器時代」
「鉄隕石」「高速度鋼」「超硬合金」「超耐熱合金」「ハリー・ブレアリー」「Karl Schroter」「鉄系合金」
「非鉄金属合金」「貴金属合金」「特殊合金」「赤金」「スターリングシルバー」「ハステロイ」「インコネル」
2025年8月5日
「化学の泉」投稿文(その43)/豆知識(はじまりシリーズ)
【金属の歴史】
以前、「(その17)金と錬金術の歴史」「(その18)冶金術と鋼鉄の歴史」「(その19)金属アルミニウムの冶金術の歴史」などで錬金術や冶金術から金属の歴史に触れてきましたが、今回は金属のみに着目してその歴史を見てみましょう。
現在、周期表にある約90種類の天然元素のうち、金属元素は約80%を占めています。現代文明は金属なしでは考えられません。いたるところに金属材料が使われています。日常生活で最も多く使われている金属は「鉄」で、全金属の90%以上です。続いて「アルミニウム」「銅」の順になります。
金属は、性質から「1.電磁波を反射する(特に可視光を反射したときの光沢を金属光沢といいます)」「2.熱伝導性に優れている」「3.電気伝導性に優れている」「4.展性(叩いて広がる性質)を持つ」「5.延性(引っ張って伸びる性質)を持つ」の5つの特徴をすべて備えるものを「金属」と定義します。
金属の使用は、古代の人々が自然界で見つけた金属を装飾品として使い始めたことから始まりました。そして、金属を加工する技術が発展するとともに、道具、武器、建築、さらには現代のテクノロジーにいたるまで、人類の歴史を支えてきました。

紀元前7000年頃、人類は自然界でそのまま見つかる金や銀、銅を装飾品として利用していました。金属は石よりも加工がしやすく、美しい光沢を持つため、宗教儀式や権威の象徴として珍重されました。例えば、金は不変の輝きと希少性から「神聖な金属」とされ、エジプトではファラオの墓に金製品が埋葬される習慣がありました。
自然銅は、紀元前9000年頃の中東で利用され始めたと推測されています。紀元前4000年頃には、火を使って銅鉱石を溶かし、道具や武器を作る技術が発展しました。この技術の発明は、単なる採取生活から生産的な生活への大きな転換点となりました。銅製の斧や槍が農業や狩猟の効率を飛躍的に高め、集落が繁栄するきっかけとなったのです。
合金である青銅(銅+錫)は、紀元前3300年頃にメソポタミア南部地方で栄えたシュメール文明で発明されたと考えられています。この合金は、純粋な銅よりも硬く、耐久性が高いという特徴を持っていました。これにより、農具や武器、装飾品の性能が飛躍的に向上しました。
エジプト文明(紀元前2500年頃)では青銅がピラミッド建設における道具として利用されました。また、中国の殷王朝(紀元前1600年頃)では青銅器が祭器として使用され、王権の象徴となりました。この時代には、青銅を求めた交易が盛んになり、地域間の文化交流も活発になりました。
古代に鉄づくりで栄えたのは紀元前2000年頃のヒッタイト帝国で、鉄製の武器でバビロニアを滅ぼしエジプトの新王国とも勢力を争いましたが、紀元前1200年頃に帝国が滅びると鉄の精錬技術は周辺諸国に拡散し、「青銅器文明」から「鉄器文明」に移っていきました。そして、鉄の加工技術が広がると、青銅は主要な金属の地位を失い始めました。それでも青銅器時代は、人類史の中で技術革新の基盤を築いた重要な時代といえます。
鉄器時代(紀元前1200年~紀元前500年頃)は、鉄鉱石を高温で処理し、鍛える技術が発展したことから始まりました。初期の鉄製品は彫刻や簡単な道具でしたが、技術が進むとともに農業用具や武器として広く利用されるようになりました。
鉄は、青銅よりも硬く安価で、大量生産が可能でした。また、鉄鉱石は地球上で豊富に見られるため、供給が安定していました。これにより、農業生産性が向上し、人口増加と都市の拡大が進みました。鉄器の普及は戦争の形態も変えました。古代ギリシア(紀元前800年頃)やローマ帝国(紀元前27年~395年)では、鉄製の武器や防具が軍事力の強化に大きく貢献しました。特に、ローマ軍の「鉄の剣」はその耐久性と殺傷力で敵を圧倒しました。
最も古い高炉は、中国の前漢時代(紀元前100年頃)のものとみられています。高炉法では高温状態で還元されてできた鉄が炭素を吸収して、融点が下がるため、1200℃程度で溶けて、液体の銑鉄(せんてつ;鉄鉱石を還元して取り出した炭素の含有量4%前後の鉄の合金)を造ることができます。
ヨーロッパにおける最初の高炉は、スウェーデンで12世紀から14世紀の間につくられました。高炉は中世を通じ、ヨーロッパ中の鉄鉱石のある地域へと伝播していき、鉄に炭素を混ぜた鋼が広く使われるようになりました。鋼は硬さと柔軟性を兼ね備えた素材であり、刀剣や鎧、農具などに活用されました。特にヨーロッパの騎士たちの甲冑は、金属加工技術の象徴です。
銀や金は中世ヨーロッパで貨幣として重要な役割を果たしました。国際交易が盛んになる中で、金属貨幣は経済の基盤となり、その加工技術は高度化しました。
この時代、金属は芸術の領域にも活用されました。教会の鐘や宗教的な装飾品、彫刻などに金属加工技術が応用され、ルネサンス期(14世紀~16世紀)に至る技術基盤が築かれました。
18世紀後半、産業革命によって鉄鋼の生産量が急増しました。蒸気機関や鉄道の登場は、鉄を不可欠な素材とし、製鉄業は経済の基盤となりました。鉄の利用が広がるにつれて、銑鉄と錬鉄(れんてつ;古典的な製鉄方法で生産された、鋼鉄よりも炭素の含有量が少ない鉄)のいいところを取り入れた、堅くてしかも粘り気のある強靭な鋼鉄「鋼」(炭素含有量0.04~2%程度の鉄の合金)が求められるようになりました。1856年、イギリス人発明家ヘンリー・ベッセマー(1813~1898年)が開発した転炉法が強靭な鋼を量産するための第一歩となり、炭素の少ない屑鉄を銑鉄と一緒に燃料を使った高熱で溶け合わせて平均して炭素の多い鋼にする「平炉法」がイギリス人電気技師カール・ウィルヘルム・シーメンス(1823~1883年)により発明され、フランス人製鉄技術者ピエール・エミール・マルタン(1824~1915年)により製鋼法が確立されました。さらに1878年 にベッセマーの転炉法ではできなかった、リン分が多い鉱石から鋼を作る「トーマス法」をイギリス人裁判所書記シドニー・ギルクリスト・トーマス(1850~1885年)と彼のいとこの製鉄所技術者パーシー・カーライル・ギルクリスト(1851~1935年)が共同で発明し鋼が大量生産されるようになりました。
1886年にフランス人化学者ポール・エルー(1863~1914年)とアメリカ人化学者チャールズ・マーティン・ホール(1863~1914年)が溶融させた原料を電気分解させるアルミニウムの製錬方法である「ホール・エルー法」を開発し、1889年にハンガリー帝国のオーストリア人化学者カール・ヨーゼフ・バイヤーが「バイヤー法」というボーキサイトをアルミナに純化する手法を発見して、バイヤー法とホール・エルー法に基づく金属アルミニウムの生産により、アルミニウムが一般人にも使えるほど広まりました。
さらに、2000年代以降は、金属ニッケルの精錬に電気精錬法が用いられ大量生産されるようになりました。アルミニウムやニッケルは、それぞれ航空機産業や電気産業で重要な役割を果たしました。特にアルミニウムは、軽量で腐食しにくい特性から、建築や輸送機器の素材として革新的でした。
1910年代前半には鉄に一定量以上のクロムを含ませた腐食に対する耐性を持つステンレス鋼(耐錆鋼)が開発され、医療用器具、台所用品、建築など幅広い分野で活用されました。
現代(20世紀~現在)のハイテク産業では、銅や金、レアメタルが不可欠です。半導体や電気配線、再生可能エネルギー技術で金属が活躍しています。例えば、リチウムやコバルトは電気自動車用バッテリーに欠かせません。
チタンや超合金は、軽量で高強度な特性を持ち、航空機や宇宙開発において必須の素材となっています。また、炭素繊維やセラミックとの複合素材も新たな技術革新をもたらしています。
現代ではリサイクル技術が進み、鉄やアルミニウムなど多くの金属が循環型社会の一部となっています。持続可能な開発目標(SDGs)の観点からも金属のリサイクルと新素材の研究が進んでいます。
レアメタルとは文字通り、レア(希少)なメタル(金属)のことです。レアメタルの「レア」は「工業的に必要だが手に入りにくい」という意味で使われています。また鉄や銅、亜鉛、アルミニウムなどのように、現代社会で大量に使用されて生産量が多く、汎用性の高いベースメタル(コモンメタル)に対して使われる言葉です。
レアメタルには、国際的な統一基準があるわけではありません。レアメタルが手に入りにくい原因としては、埋蔵量が少ない、加工や精製が難しい、産出国が極めて少ないことなどがあげられます。日本では、レアメタルは、経済産業省が1980年代に指定した「存在量が少ない」「取り出すのが困難」などの基準により47元素とされています。天然元素約90種類の半分近くがレアメタルになります。埋蔵量が多くても、抽出が困難な金属も含まれており、手に入れにくさに加えて、今後の工業用需要についても加味されています。
日本におけるレアメタルは、リチウム(Li)、ベリリウム(Be)、ホウ素(B)、チタン(Ti)、バナジウム(V)、クロム(Cr)、マンガン(Mn)、コバルト(Co)、ニッケル(Ni)、ガリウム(Ga)、ゲルマニウム(Ge)、セレン(Se)、ルビジウム(Rb)、ストロンチウム(Sr)、ジルコニウム(Zr)、ニオブ(Nb)、モリブデン(Mo)、パラジウム(Pd)、インジウム(In)、アンチモン(Sb)、テルル(Te)、セシウム(Cs)、バリウム(Ba)、ハフニウム(Hf)、タンタル(Ta)、タングステン(W)、レニウム(Re)、白金(Pt)、タリウム(Tl)、ビスマス(Bi)、希土類元素「ネオジム(Nd)、ジスプロシウム(Dy)、ランタン(La)、サマリウム(Sm)など17元素を含む」です。
レアメタルは、最新の工業技術にとっても重要な働きをしていて、日本のものづくりにとって欠くことができない重要な資源の総称です。素材に少量添加するだけで性能が飛躍的に向上するため、「産業のビタミン」とも呼ばれています。主な機能には、磁性、触媒、工具の強度増強・発光・半導性などがあります。これらを利用した機器は携帯電話、デジタルカメラ、パソコン、テレビ、電池、各種電子機器などさまざまです。レアメタルは、現在の私たちの暮らしをより豊かにするために必要な機器を作るのに不可欠です。
たとえば、希土類のサマリウムなどを使った強力な永久磁石の登場で、モーターの小型化を実現し「軽薄短小」の電子機器が開発されました。現在、最も強い磁力を持つといわれている永久磁石の「ネオジム磁石」は、主成分が鉄、ホウ素、と希土類のネオジムです。
レアメタルの主な産出国は中国、ロシア、北米、南米、豪州、南アフリカなどです。残念ながら日本には算出を誇れるようなレアメタルはありません。
生産量が一位である中国は、レアメタルを国家戦略の柱と位置づけています。たとえば2010年9月に尖閣列島沖で起きた中国漁船衝突事件などをきっかけに日中関係が悪化したとき、中国政府は日本に対しる制裁処置として、希土類の対日輸出を規制したことがあります。
中国の輸出規制により、日本は原料不足となり生産に影響が出ました。近年、日本はレアメタルの安定した供給のために中国への依存度を下げるべく、他国との協力関係を広げ、国家的な備蓄も進めています。
埋蔵量の限られた希少なレアメタルを有効に使うためにはリサイクルに加えて、同じ性能を持つもので代替して使用量を抑えることも必要です。現在、レアメタルの代替技術の研究開発が進められています。
金属の進化は、文明そのものの進化を映し出しています。未来においては、AIやナノテクノロジーの発展により、金属の利用がさらに多様化し、効率的かつ持続可能な方法で活用されるでしょう。同時に、新しい金属材料の発見やリサイクル技術の発展が、環境保護と社会の進歩を支える重要な鍵となるでしょう。
文献:
ウィキペディア・フリー百科事典
「金属」「銅」「青銅」「エジプト文明」「殷王朝」「ヒッタイト帝国」「青銅器時代」「鉄器時代」
「古代ギリシア」「ローマ帝国」「高炉法」「銑鉄」「ルネサンス」「産業革命」「錬鉄」「鋼」
「ヘンリー・ベッセマー」「転炉法」「平炉法」「カール・ウィルヘルム・シーメンス」
「ピエール・エミール・マルタン」「トーマス法」「シドニー・ギルクリスト・トーマス」
「パーシー・カーライル・ギルクリスト」「ポール・エルー」「チャールズ・マーティン・ホール」
「ホール・エルー法」「カール・ヨーゼフ・バイヤー」「バイヤー法」「ステンレス鋼」「ニッケル」
「レアメタル」
2025年7月14日
「化学の泉」投稿文(その42)/豆知識(はじまりシリーズ)
【酒(アルコール)の歴史】
私たちと酒(アルコール)との付き合いは、おそらく今から1億4千万年前までさかのぼると考えられます。それは、果実をつける種子植物(花を咲かせる植物)が登場した時代です。その頃の私たちの祖先は、まだ人類になっていなくて、最初の霊長類(primate)に進化する前の恐竜に怯えるネズミのような初期哺乳類でした。そこに、サッカロミセス・セレビシエ(出芽酵母)という果実を好む「酵母」が現れました。
サッカロミセスは、果実の果糖やブドウ糖などの糖から生活のエネルギーを得ています。アルコールを副産物としてエネルギーを得る方法は、けして効率は良くないけれど、アルコールを毒とする他の微生物を寄せ付けない効果がありました。そして、果実を食べる哺乳類は、果実が成熟したかどうかをアルコールの匂いで知ることができる種が有利になりました。初期霊長類はこの種の一つでした。そのために私たちの祖先は、アルコール好きの性質を持って進化してきたと考えられます。

はじめは、果実や蜂蜜などが自然発酵によって酒ができたと考えられます。酒を造る酵母は自然界では糖分の多い環境に暮らしていて、果実の皮などにも付着していました。そのため、果実をつぶして容器に入れて置けば、次第にアルコール発酵が進む場合が多かったのでしょう。木でも石でも窪みがあるところに果汁や蜂蜜を放置しておけば、自然界にある酵母の胞子が入り込んで発酵が始まり、自然に「お酒」が出来上がったと考えられます。
水以外の「飲み物」が世界史上に本格的に登場したのは約1万年前のことで、丁度ホモ・サピエンスが定住生活をし、農耕革命を起こしたときでした。
現状、年代が確認された最古のアルコール飲料の遺物は、中国の河南省にある賈湖(ジャフー)遺跡で発見された約9千年前のものです。2004年にこの遺跡から発見された壺の内部に残っていたものを化学分析すると、「米、蜂蜜、ブドウ、サンザシ(中国中南部が原産の果実)」が使われていることが分かりました。9千年前の人々は、これらの材料を混ぜた複雑な発酵飲料を味わっていたのでしょう。
ビールは穀物が原料です。かつての人類は、ビールを皮袋や動物の胃袋、くり抜いた木や石、大型の貝殻などで作っていました。最初の大麦ビールの痕跡は、現在のイランにあって、紀元前5千年までさかのぼります。紀元前4千年前までには中近東一帯に普及しており、発祥の地はティグリス・ユーフラテス川流域のメソポタミア平原とされています。また、ビールへの欲求から農業が本格化したという見方もあるようです。原料を野生の穀類に頼ったままでは安定してビールを作ることはできません。そこで耕作で穀物を確保すべく、「栽培」をするようになったとの見解です。
紀元前4千年頃の現在のイラクにあたるメソポタミアの土器に、二人の人物が大きな陶製の瓶からストローでビールを飲んでいる姿が描かれていました。当時のビールには、穀物の種や殻、その他の「ごみ」が浮かんでいたので、飲むためにはストローが必要だった様です。しかし、「ごみ」といっても沸騰した水を使って作るので煮沸殺菌されており、安全性の高い飲み物でした。
この頃、メソポタミア文明を開いたシュメール人はムギ類の栽培を行っていました。麦芽を作って乾燥させ、これを小麦の粉に混ぜて、パンに焼き上げた後に砕いて湯で溶き、自然発酵させてビールを作ったといわれています。
農業を中心とした定住生活をするようになると、余剰穀物のおかげで農業に従事せずに、別の仕事をする人々も出てきましたが、彼らの給料はパンとビールで支払われました。例えば、紀元前2500年頃、エジプトのピラミッド建設の労働者への標準的な配給は、国家が穀物を貢ぎ物として集め、労働の対価として再分配したパン3~4斤とビール約4リットルでした。古代エジプト人にとってビールはとても身近な飲み物で、アルコール度数が約10%と現在よりも高いビールを家や居酒屋で飲むことができていました。現在の私たちの宴会と全く変わらない飲み過ぎを注意する当時のパピルス文書が残されています。
ビールは、紀元前8世紀から紀元前7世紀にアッシリア人に好まれて、次第にギリシア、ローマへと伝わりましたが、ギリシアとローマはワインを重視したために、麦作をしていた北欧のゲルマン人に引き継がれていきました。
パンは、小麦粉、ライ麦粉などパン用の穀物の粉を、酵母(イースト)、水、食塩を中心とした材料を使ってよく混ぜ、練って発酵させた生地を焼いた食品です。
発酵して膨らむパンの歴史は、紀元前4千年頃のエジプトにさかのぼります。それまで小麦粉を粗粒にして水でこねたものを平焼きにしていました。それがパンの原型でした。しかし、あるときに偶然にも、小麦を水でこねて、しばらく放置しておいてからパンを焼くと、生地が膨らんで柔らかく仕上がることを発見しました。おそらく、自然界の酵母が生地に付着していたのだろうと思われます。しかも、生地の一部は、次のパンのタネとして使うことができました。さらに、ビール造りでできた泡をタネに加えれば、もっとよいパンが焼けることに気が付きました。パン作りの主役はビールなどのアルコールを作る酵母でした。酵母はパン生地に含まれているブドウ糖や麦芽糖などを栄養に発酵し、発生する二酸化炭素で生地が膨らんだのです。
さらに、一緒にできたアルコールはパンを焼くときに揮発してしまいますが、わずかに残っていい香りを与えることができました。
お酒のアルコールを作るのは、酵母という微生物です。微生物には真菌類というグループがあり、見た目でカビ・酵母・キノコに分けられます。酵母はカビやキノコに近い微生物です。カビ(糸状菌)は、胞子が発芽すると数日で糸状の菌糸が放射状に枝分かれしながらみるみる伸びていきます。そして菌糸の先端に胞子を作り、飛散させて繁殖します。
酵母は1/100ミリメートルほどの大きさの単細胞生物で、球形や楕円形、ソーセージ形など様々な形を取り、出芽や細胞分裂で増殖します。カビとは異なり酵母の細胞は一般的に糸のようにつながっていません。酵母が増殖すると、バラバラの細胞が集まって、粘性のある球形の塊を形成します。しかし、酵母の一部には、ヒトの常在菌のカンジタのように生育条件が変化するとカビのように糸状の菌糸が生えるものもあるので、カビと酵母の区別には曖昧なものがあります。それでも酵母には発酵などで重要なものが多く、実用上でカビとは区別されます。
先に述べたようにビール、ワイン、日本酒、パンは、サッカロミセス・セレビシエという酵母の働きによって作られています。同じ酵母でも菌株はそれぞれに適したものを使い、例えばビールに使う酵母はビール酵母と呼びます。
酵母サッカロミセス・セレビシエは、ブドウ糖を好んで食べ、アルコールと二酸化炭素にします。サッカロミセスはギリシア語で「砂糖の菌」を意味し、セレビシエはラテン語で「ビール」を意味します。
酵母はブドウ糖や麦芽糖をもとに発酵しますが、デンプンでは発酵しません。ワインはブドウの果汁にブドウ糖を多く含むので、そのままワイン酵母で発酵させることができますが、大麦や米などデンプンをもとに酒を作る時には、デンプンを麦芽糖やブドウ糖に分解する必要があります。これを「糖化」と呼びます。例えばビールは大麦を原料にしていますが、大麦を発芽させて麦芽にすると酵素アミラーゼが分泌され、大麦のデンプンを麦芽糖やブドウ糖に分解します。このように糖化してからビール酵母で発酵させます。日本酒は米のデンプンをコウジカビ(麹)で糖化し、生成したブドウ糖を酒酵母で発酵します。
ブドウ糖を酵母で発酵させると、アルコールと二酸化炭素以外に酸やアミノ酸、香気成分などを生成します。
中世になると、ヨーロッパでは、当時学問の府であった修道院がビール製造の中心になっていました。ビール醸造室とパン製造室が隣り合って配置された修道院もあったようです。11世紀後半になると、ホップを使うとビールの品質が良くなることが分かり、ホップビールが次第に広まっていきました。
1516年、ミュンヘンの王侯であるバイエルン公ヴィルヘルム4世(1493年~1550年)により、粗悪なビールの流通や、食用である小麦がビールの原料に転用される事による飢餓を防ぐため、「ビールは大麦、ホップと水で作る」と定めたビール純粋令が布告されました。ドイツでは、現在もこの基準が踏襲されています。
16~17世紀になると、修道院で行われていたビール製造が、国家、あるいは市民の手に移っていきました。大航海時代には、ビールは腐りやすい水の代わりに飲料用として用いられ、イングランド王兼スコットランド王ジェームズ1世(1566年~1625年)による弾圧を恐れて、アメリカに渡ったイングランドのピューリタン(清教徒)たちが1620年にイギリス南西部の港湾都市プリマスから、新天地アメリカ大陸へ渡航したメイフラワー号には、400樽ものビールが積み込まれていました。つまり、ビールが無ければ大航海時代は続々と成果を上げることが出来なかったかもしれません。

ワインは潰したブドウの果汁を発酵させたものです。おそらく最初は、ブドウの皮に付いていた天然の酵母によってアルコールが出来たのでしょう。
最古のワインの遺物は、現在のジョージア(旧グルジア)が位置しているコーカサス山脈周辺から見つかっています。2017年に、土器が吸収した成分を化学分析すると、ユーラシア地域のブドウを醸造したことを示す物質が検出されました。その土器には、ブドウの房や踊る男性の素朴な画が描かれていたそうです。
この地域は、ワイン醸造の遺跡も残されており、8千年以上も前からワインが親しまれていたことが遺物の分析から分かっています。
穀物や果物を酒に変える技術は、ヒトを酔わせるアルコールの作用が解明される以前は、大変に不思議な事であり、神秘性や宗教性が付与されていました。そうした宗教的飲み物の代表がワインでした。ワインはメソポタミア、エジプト、クレタ島を経由してギリシア世界に伝えられ、ギリシア、ローマで広く愛飲されるようになりました。
古代ギリシアのワインは、今と違ってそのままでは飲めないくらいどろどろとした濃厚で粘り気があり、水などで割らないと飲めなかったようです。ギリシア人にとってワインの割り方や飲み方にこだわりを持つことが、自らの洗練さを強調する行為であったようです。

蒸留という操作は、物質の沸点の違いを利用して、いったん気体にしてから、それを冷却して混合物質を分離する方法です。蒸留には、「レトルト」というガラス器具が良く使われました。球状の容器の上に長くくびれた管が下に向かって伸びている形をしています。液体を入れて球状の部分を加熱すると、発生した蒸気が管の部分で結露して、管を伝って取り出した物質を容器に集めることが出来ます。レトルトは錬金術で広く用いられた蒸留装置です。
中世の錬金術師によって蒸留酒を作る技術は確立されました。強い蒸留酒は、何度も蒸留を繰り返して作られました。最初の蒸留操作では「燃える水」と呼ばれる約60%のアルコールが得られます。さらに蒸留を繰り返すと、「アクアヴィテ(生命の水)」と呼ばれる約96%のアルコールが得られます。僧侶や薬剤師は、アクアヴィテに薬草などを溶かし込んで、貴重な薬として扱いました。そのために、ヨーロッパを襲ったペストがアクアヴィテ、つまり蒸留酒が普及するきっかけとなり、ペストの流行が去った後も蒸留酒を飲む習慣が残りました。高濃度のアルコールの蒸留酒が持つ「短時間で簡単に酔うことが出来る」性質が人々の心をとらえたようです。
12世紀のころ、「聖なる水」と呼ばれる、穀物を原料とする蒸留酒「ウィスキー」がアイルランドで初めて作られました。そして16世紀になると、ウィスキーはスコットランドで一般化しました。そして、大航海時代には、当初はワインやビールが積まれていましたが、場所を取らないでより多くのアルコールを船に積むことが出来て、しかも、腐ることが無く長期間の保存に適した蒸留酒が取って代わりました。
17世紀には、イギリス、フランス、オランダがカリブ諸島で砂糖キビのプランテーションをつくり、その労働力のために奴隷貿易が盛んになりました。アフリカの奴隷との交換品は、布地、貝殻、金属製の器、水差し、銅板など多岐にわたり、最も貴重だったのは布地でしたが、ワインを蒸留したブランデーも人々の心をとらえたようです。その後、砂糖を製造すると出る廃棄物である糖蜜からつくる、格安で強い蒸留酒、ラム酒が人気となりました。航海と共に蒸留酒は世界に広まり、やがて人々の生活の中に浸透していきました。
こうして、世界にウィスキー、ブランデー、ウォッカとさまざまな蒸留酒が現れ、現在、私たちの前には各種の蒸留酒(スピリッツ)が存在するようになりました。
アルコール系飲料は、世界保健機構(WHO)のガン研究専門組織である国際ガン研究機関(IARC)による発ガン性評価で、明確な科学的根拠に基づいたヒトに対して発ガン性がある「グループ1」にランクされています。IARCの発ガン性評価は、ヒトに対する発ガン性に関するさまざまな物質、要因を評価し、5段階に分類しています。この評価は発ガン性の強さではなく、ヒトや実験動物における発ガン性の証拠の強さを評価したもので、「グループ1」にランクされても、その摂取や暴露がただちに発ガンにつながるわけではありません。発ガン性の強さ、発ガンに至る量や時間というリスクの大きさは考慮されていません。つまりアルコール系飲料は、発ガン性物質としての「証拠」の強さではピカイチと言えます。
ヒトが、解毒能力を超えてお酒を飲み続けると、血液中のアルコール量が増加し、合理的で分析的な思考や、言語機能をつかさどる「大脳新皮質」にとどまらず、情緒や意欲、そして記憶や自律神経活動に関与している「大脳辺縁系」、知覚や運動機能を統合する「小脳」、多数の生命維持機能を含む「脳幹」などの他の部分も麻痺し始めます。後は、飲むほどに、酩酊(めいてい)、泥酔、昏睡状態となり、やがて死に至ります。これを急性アルコール中毒と言います。
飲んだアルコールが脳に到達するまでには30分程度かかると推定されています。そのため、飲み始めてから酔いを感じないからとどんどん飲み続けると、時間がたってから一気に血液中のアルコール濃度が高まり、突然記憶をなくすなどの症状が現れ、最悪死に至ることがあります。
最初は大きな声を出して騒いでいたヒトが、そのうちにまっすぐ歩けなくなり、千鳥足になったり、ろれつが回らなくなったりした場合には、すぐに飲酒をやめるか、またはやめさせる必要があります。さらに、無理矢理アルコールを飲ませたり、一気飲みをさせたりすれば、死を招くこともあります。一気飲みは絶対にやってはならない大変危険な行為です。
アルコール依存症になると肝臓を壊し、また飲酒により社会的な問題を引き起こすリスクが高まります。さらにいったん飲み始めると、アルコール摂取を止めるというブレーキが壊れた脳の状態になり、職場や家庭内で様々な問題を起こし始めます。
仕事の後、スポーツの後、親しいヒトとの語らい、日頃のストレスの解消に、お酒はこよなき人生の友達ですが、ときにはヒトの体や心を駄目にする悪魔の飲み物になることを忘れてはいけません。
文献:
ウィキペディア・フリー百科事典
「酒」「種子植物」「サッカロミセス・セレビシエ」「賈湖遺跡」「ビール」「パン」「ワイン」「日本酒」
「バイエルン公ヴィルヘルム4世」「ビール純粋令」「大航海時代」「ジェームズ1世」「メイフラワー号」
「ジョージア」「レトルト」「蒸留酒」「ウィスキー」「ブランデー」「ラム酒」「世界保健機構」
「国際がん研究機関」「大脳新皮質」「大脳辺縁系」「小脳」「脳幹」「急性アルコール中毒」
2025年6月2日
「化学の泉」投稿文(その41)/豆知識(はじまりシリーズ)
【上下水道の歴史】
水は、ヒトを含む多くの生命体にとって不可欠な物質です。
人体における水分量は年齢・性別によって異なり、新生児で約80wt%、成人で60wt%前後、高齢者は50wt%台となります。一般的に、健康な成人男子で約60wt%、女子で約55wt%占めています。男女で水の割合が異なるのは、男子は水分が多い筋肉組織が多く、女子は水分が少ない脂肪組織が多いためです。
成人男子60wt%の水のうち45wt%までが、細胞内に封じ込められた水で、残り15wt%が血液・リンパ液など細胞の外にある水です。この細胞内液、細胞外液の両者を総称して「体液」と呼びます。この体液が生命の維持、活動に重要な役割を果たします。
水(H2O)は、水素と酸素の化合物で水分子の酸素原子と水素原子は共有結合で結びついています。分子全体でもH-O-H結合角が約104.45°と分子が曲がっていることから「極性」を持ちます。そのために、水の20℃における比誘電率(媒質の誘電率と真空の誘電率の比)は 79.87と高く、このためイオン間の静電気力を弱め塩化ナトリウムなどのイオン結晶の結合格子を破壊して溶解させます。また、周期表の右上に位置する元素、フッ素(電気陰性度:3.98)や酸素(同:3.44)、塩素(同:3.16)、窒素(同:3.04)、炭素(同:2.55)などのように、原子が電子を引き寄せる強さの相対的な尺度である「電気陰性度」が高い原子に結合している水素原子は、水分子とお互いの電荷がプラスの所とマイナスの所が引き合って水素結合を形成します。従って水は、糖などイオン性ではない分子に対する溶解性も示します。体液を含め「水」は、すぐれた「溶媒」として働きます。
体の中を駆け巡る血液は、様々な物質を溶かし込んでいます。体の中をぐるぐる回りながら、各細胞に栄養分と酸素を届け、老廃物を受け取って捨てるのは、水の大切な働きの一つです。
ヒトが生きていくために必要な水の量は一日に約2~2.5リットルといわれています。その量は体の大きさのほか、外気の状態や運動の有無などによって左右されます。
一方、体から出ていく水は、大部分が尿や汗などです。私たちの体を出入りする水の量は、入る水と出る水がほぼ同量でバランスがとれています。
歴史的に見ると17世紀初めに、ヒトの代謝廃棄物の排出に関する最初の制御実験をイタリア人の医師で生理学者のサントーリオ・サントーリオ(1561~1636年)が行い、自身が食事、睡眠、労働、交接、飲酒、排泄の前後でいかに体重が変化したかを説明し、摂取した飲食物のほとんどが、尿のように分かりやすい形ではなく、目に見えない形で普段感じることなく発生している皮膚の表面からの発汗や呼吸で水蒸気として水が失われていることを見出しました。彼はこれを「不感蒸泄(ふかんじょうせつ)」と命名しました。
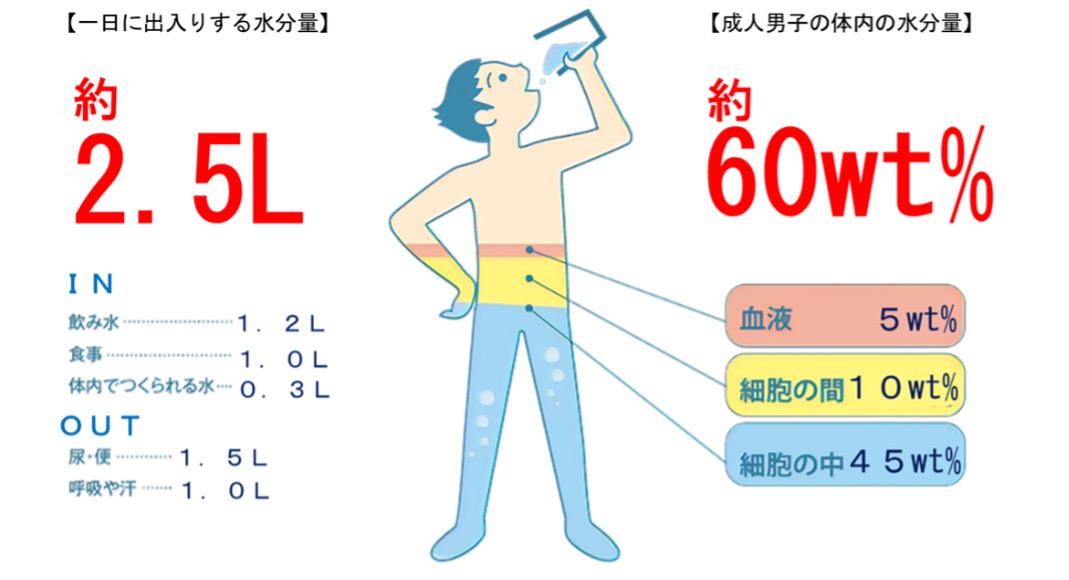
1日に排出される水の量は体重60kgの成人男性で2.5リットルであり、内訳としては尿が1.4リットル、糞0.1リットル、汗0.5リットル、肺からの呼気0.5リットルです。また、1日に必要な水の量は当然2.5リットルで、一般に飲料水から1.2リットル、食物から1.0リットルが摂取され、残りは体内で行われた代謝の結果生じた水を0.3リットル得ていると言われています。
栄養分や酸素の運び役として、化学反応の場として、また、体温や浸透圧の調整役として、水は私たちの生命維持に欠かせない重要な物質です。
私たちの体内の水の20%が失われると死に至ると言われています。体重が60kgのヒトの場合、体の水の量は体重の60%で約36リットルなので、その20%は、7.2リットルです。尿や汗などでヒトは一日に約2.5リットルの水を体外に排出しているので、7.2リットルといえば、約2.9日分の水の量です。もちろん実際に水を断ったら体から出ていく水の量も減るので、もっと長く生きられると考えられますが、計算上では、水を三日間飲まないだけでも生命は危険にさらされることになります。
そのため、宗教の修行などで断食をする場合でも、食べ物は摂らなくても水は飲みます。健康な成人は、何も食べなくても水さえ飲んでいれば3週間程度は生きることができます。それだけ水は生命にとって重要なものなのです。
また、水は強力な水素結合で水分子同士が引き合っているために蒸発潜熱が大きいので、汗が蒸発することにより、非常に効率良く体温を放散できます。しかし、発汗しても液体として流れ落ちる量が多い時は、この限りではありません。
十分な水を飲むことは多くの理由で重要です。細胞に栄養素を供給し、体温と血圧を調節し、関節を滑らかにし、感染を防ぎ、臓器が正しく機能し続けるのを助けます。水はまた、食物が消化管を通って移動し続け、腎臓の健康をサポートします。全米医学アカデミーは、健康な男性が1日あたり200mLのカップで13杯程度の水分を摂取することを示唆していますが、そのすべてが水や無糖の炭酸水などの液体である必要はありません。多くの食品にはかなりの量の水分が含まれています。尿の色は、水分摂取量を監視する簡単な方法です。十分な水分が補給されているとき、尿は透明と軽いワラの色の間にあり、濃い黄色または琥珀色は、より多くの水を飲む必要があることを示しています。
安全な水を飲めるかどうか、ということはヒトの健康に大きな影響を及ぼしています。汚物などに触れた不衛生な水を飲むと、コレラや腸チフス、赤痢などの感染症で命を落とすヒトが出ます。そしてこれらの病気は伝染します。体力の弱い乳幼児は、不衛生な水を摂ると、しばしば酷い下痢を起こし脱水症状で死亡します。老人も免疫力が弱く、不衛生な水で命を落とし易くなります。また、不衛生な水は寄生虫の問題も引き起こします。
古代でも中世でも、人類のほとんどは水道無しで生活していたと考えて良いでしょう。都市で暮らすにしても上水道がありませんでした。安全な水を飲む方法として古代から行われている1つの方法は、煮沸(しゃふつ)してから口に入れる方法でした。他にも、太陽光による殺菌を行う太陽水殺菌などがありました。
世界の水道の起源として紀元前312年に整備された古代ローマのアッピア水道が挙げられることがあります。しかし、より古くインダス文明(紀元前2600~紀元前1800年頃)のモヘンジョダロが挙げられることもあります。
古代ローマ帝国(紀元前753~476年)は、土木技術に秀でており、ローマに水を引くべく水道を建設しました。これのおかげでローマという都市に住む市民は公衆浴場を利用することができました。ローマには公共の水洗トイレもありました。石製のベンチ状の物の下を水が流れていて、ベンチには穴があいており、そこに腰かけて用をすれば、排泄物が流れてゆく仕組みでした。ローマのように水がふんだんにある都市生活は世界的に見て例外的であり、他に類を見ない状態でした。ローマ帝国の時代、ローマという都市に住む人々は風呂に頻繁に入っていたわけですが、その後、かつてのローマ帝国の中核的市民で、今のローマ市民やイタリア人は頻繁に風呂に入る習慣を失いました。
都市では、都市で生活する者に安全な飲料水をいかにして届けるかということは、都市を治める者、政治を行う者にとって大きな問題でした。
中世ヨーロッパ(5世紀~15世紀頃)では、各都市は外敵を防ぐべく壁を建設した城塞都市で、自治が行われ、独立性が高く、小さな国のような様相を呈する都市が多くありました。ヨーロッパの都市では、街の広場などに、都市の近くの山などから水道で水を引き、その水を出す「泉(フォンテ)」を設置して、飲料水を市民に提供している都市が多くありました。市民は桶を持って広場にやってきて、この泉で水を汲んで、水が入った重い桶を家まで運び、各家でそれを使いました。つまり「水道」があるといってもその程度のことであり、基本的に各家まで引かれていたわけではありませんでした。
16世紀になるとようやく、市民生活の衛生を保つことが重要視されるようになり、少しずつではありますが、小規模の上水道の工事が行われるようになりました。ヨーロッパ最初の公共給水は、1830年に産業革命の先進国であるイギリスのロンドンで実施されました。
中近世のヨーロッパの水事情を理解するための例の1つとして、フランスの首都のパリの水事情について説明すると、パリの水事情は劣悪でした。16世紀・17世紀・18世紀と、パリ市民は安全な飲料水をたっぷりと確保できていたわけではありません。基本的に、風呂に入る、などということは考えられない状態でした。やることと言えば、布に水や湯を含ませて身体を拭く程度でした。身体があまりに臭くなったら、桶や金たらいを用意して、服を脱いでその中で立って、桶にくんだ水を身体にかけ、数分後には身体を拭く、という程度でした。 汚水の扱いも酷い状態で、パリに下水道が整備されていなかったため、市民は、汚物を家(アパルトマン)の前の街路に捨てていました。当時、パリの街路は道の端や真ん中に水が集まるように溝があり、雨になるとそこを雨水が流れるのですが、そこに汚物が大量に流れ、街全体に悪臭が漂っていました。そのような状態が常態化すると、終わりには、建物の3階・4階などに住み、いちいち1階まで歩いて降りる手間を面倒に感じる者などが、桶に入った汚物を窓から直接放り投げるような不届き者すらいました。パリの街を歩くには、足元の汚水にも気を付けなければならないし、同時に、頭上にも注意を払って汚物をかけられないように気を付ける必要すらあったのです。
この状況が変わったのは19世紀のことで、フランスのセーヌ県知事ジョルジュ・オスマン(1809~1891年)が行ったフランス最大の都市整備事業であるパリ改造(オスマニザシオン)の成果です。オスマンは、パリ市民のために安全な水を豊富に確保するために、パリから100kmも離れた水源からパリに水を引くという決断を行い、それが成功し、各家庭に充分に水を届けることが可能になり、その結果、当時、パリの各家庭でバスタブを置き風呂に入るということがちょっとした流行になりました。
日本の江戸では、水不足の状態を改善するために、承応元年(1652年)11月に玉川上水の建設が計画され、翌承応2年(1653年)4月より、まずは本線の建設が着工されました。難工事で幕府の用意した資金は底をついてしまい、玉川兄弟は自宅を売って建設を続行したといわれています。承応3年(1654年)6月から、江戸市中への通水が開始されました。京都では明治18年(1885年)に琵琶湖第一疏水を着工し、明治23年(1890年)に完成しました。
古代より河川や湖沼から水路を通して集落さらには都市に水を供給することが行われ、水源から開水路や石樋、木樋などを設置して自然流下で給配水する方式がとられていました。しかし、19世紀になると、近代水道の三大発明と称される蒸気ポンプによる「有圧送水」、排水用の鋳鉄管(ちゅうてつかん)および砂による人工的ろ過による浄水装置が発明され、水をきれいに処理して、ポンプによって送水する「ろ過処理」「常時給水」などの技術革新を生じ、ヨーロッパから大規模な近代水道の条件が整っていきました。
上水道とは、一般的には飲用に適する水を供給するための施設を指します。水を排出する施設である下水道などとの区別を強調する場合に上水道と呼ばれます。近代的な意味では、有圧送水、ろ過浄水、常時給水の3つの特徴を有するものを近代水道と呼びます。
近代水道の始まりについても様々な捉え方があり、1787年にパリで蒸気式揚水用ポンプが使われたのが始まりと紹介するものもあれば、1808年にイギリスのグラスゴーで水道会社が横流れ式の砂・砂利ろ過池でろ過して給水を行ったのを始まりと紹介するものもあります。
1831年のイギリスにおけるコレラの流行は、ロンドンの地下下水道を発達させましたが、せっかく下水道ができても河川に放流するだけだったので、河川はますます汚染されて、工業用水としても使用不可能なものになりつつありました。1861~1875年にはテムズ川の両岸に川と並行の下水水路をつくって流しましたが、それでも下流の汚染は防げませんでした。
19世紀後半からは、ドイツやフランスの都市でも下水道がつくられるようになりました。下水を噴水のようにして「ろ過材」にまき、その表面にできる細菌の膜で汚染物を分解する方法、あるいは、現在の下水処理場で行われている、好気性微生物を含んだ汚泥で有機物や無機物を分解する「活性汚泥法」が考案され、改善されてきました。
このように急速に上水道が敷かれていった背景には、水系伝染病であるコレラの大流行がありました。
現在では、改善されつつあるとはいえ、コレラ・チフス・赤痢などの病原菌を含んだ水や、自然環境中に広く存在しているヒ素が基準以上に含まれている水を飲まざるを得ないなど、いまだに世界には安全な水を飲めない人々がいます。ヒ素で汚染された地下水の飲用による慢性ヒ素中毒は、インド、バングラデシュなど世界各地で発生しています。
2017年時点でも、毎年52万5000人の5歳未満児が下痢によって命を落としています。トイレの不足など不衛生な環境と汚染された水が原因とされていて、水に関係した衛生状態の改善により、予防することが可能です。
水が伝染病の大きな媒介物になっていることから、「水を消毒して供給する」ことの重要性が認識されるようになりました。19世紀末には、イギリス、ドイツ、アメリカなどで水道水に塩素剤が試験的に使われはじめました。20世紀になると塩素剤による消毒の研究がますます盛んになりました。塩素剤は伝染病発生時の緊急時に使用されていましたが、1902年にベルギー、1905年にはイギリスで継続的に使われるようになり、1912年にドイツで塩素注入器が発明されると、各地で塩素消毒が行われるようになりました。
日本では1945年に終戦を迎えると、GHQ(連合国軍最高司令官総司令部)から浄水場において消毒用の塩素を常時注入することが指示されました。その後、政府は「水道管の末端においても0.1ppmの遊離残留塩素があること」を定めました。これは「水道法」に引き継がれて現在に至っており、浄水場では水を処理してきれいに安全なものにしたうえで、塩素や次亜塩素酸ナトリウムを投入して塩素殺菌をして家庭などに配水しています。
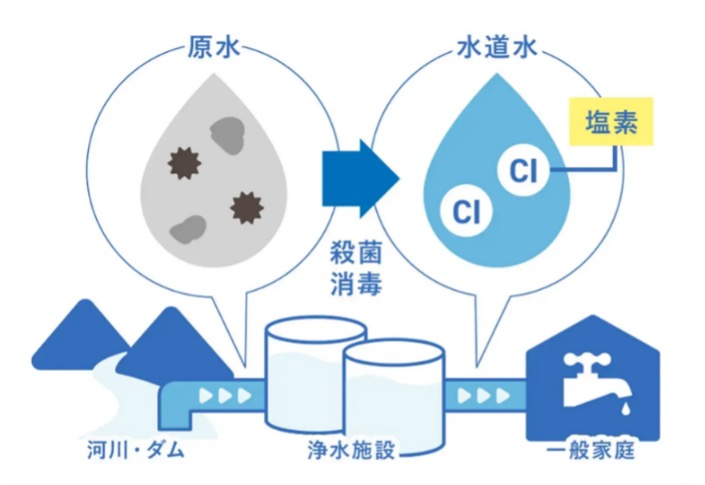
遊離残留塩素には消毒効果があります。それは、塩素が水と反応してできる次亜塩素酸(HClO)とそれがイオン化した次亜塩素酸イオン(ClO-)の強い酸化力によるものです。炭素や水素からできた有機物であれば、その中の炭素や水素の一部を二酸化炭素や水にするなどして分子を変えることにより、有機物からできた細菌やウィルスに殺菌作用をもたらします。
なお、殺菌作用を示す濃度は、ヒトの健康に悪影響を及ぼす可能性がある濃度の1/1000以下とかなり低いため、塩素の酸化作用がヒトの健康に悪影響を及ぼす可能性は低いと考えられています。
水の使用形態は大きく都市用水と農業用水に分けられ、さらに都市用水は生活用水と工業用水に分けられます。
世界の水の使用量は、1995年の段階で年間約3572km3で、内訳としては、農業用水が約2503km3/年で約70%を占め最大で、工業用水が約715km3/年(約20%)、生活用水が約354km3/年(約10%)と推定されています。水使用量は1950年から1995年までで2.6倍になっているともされ、2025年には30億人以上が水の量と質の限界である「水ストレス」に直面する、とも予想されています。
家庭での水の使用量は、地域によって著しく異なります。途上国の中には、1日1人当たり数リットル程度の国も見られます。その一方で、先進国では1日1人当たり数百リットルという国が多く、途上国と先進国の間には大きな差があります。日本の家庭の使用量も他の先進諸国と同様、特に多い部類に入ります。
日本での使用状況の1例として2005年の東京都水道局の調査報告によると、東京の家庭での水の使用量は、1日1人当たり242リットルです。また、2002年の東京都水道局の報告によると、家庭での水の使用量のうち、28%がトイレ、24%が風呂、23%が炊事、17%が洗濯でした。
地域によっては現在でも水道が無い国が多くあります。毎日水をバケツなどで家まで運ぶ地域もあります。さらに、水源が遠いため自力で長距離を歩かなければならず、その労働を担う子供が通学さえままならない地域もあります。
地球温暖化による異常気象で淡水資源量の減少が指摘される今、世界各地において水の利用効率を大幅に改善し、淡水の持続可能な採取及び供給を確保し水不足に対処するとともに、水不足に悩む人々の数を大幅に減少させる地球規模の対応が求められています。
文献:
ウィキペディア・フリー百科事典
「水」「溶解」「溶媒」「比誘電率」「電気陰性度」「サントーリオ・サントーリオ」「水の性質」
「アッピア水道」「インダス文明」「古代ローマ帝国」「玉川上水」「琵琶湖第一疏水」
「ジョルジュ・オスマン」「上水道」「下水道」「活性汚泥法」「GHQ」「塩素消毒」「次亜塩素酸」
2025年5月7日
「化学の泉」投稿文(その40)/豆知識(はじまりシリーズ)
【水の歴史】
水(H2O)は室温で無味無臭の極性のある液体です。周期表の第16族に属する酸素属元素(カルコゲン)である、「酸素(O)・硫黄(S)・セレン(Se)・テルル(Te)・ポロニウム(Po)」と「水素(H)」が化合して形成される二元的化合物で、水素と酸素とによって構成されるカルコゲン化水素の一つである水酸化水素(オキシダン)です。
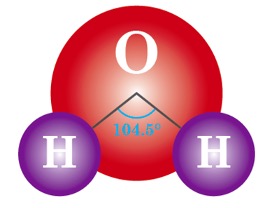
水は化学的には化学式「H2O」で表される、水素と酸素の化合物です。水分子の酸素原子と水素原子は共有結合で結びついており、その結合は水素原子と酸素原子から価電子を1つずつ供給されてできています。さらに、酸素原子の最外殻には共有結合に使われていない孤立電子対が2つ存在します。
水素と酸素の電気陰性度の違いから、O-H結合においては酸素原子側が電気的に「負(-)」、水素原子側が「正(+)」となり、局所的に大きさの等しい正負の電荷が無限小の間隔で対となって存在する電気双極子を作っています。分子全体でもH-O-H結合角が約104.45°と分子が曲がっていることから「極性」を持ちます。以上の理由から水の20℃における比誘電率は 79.87と高く、このためイオン間の静電気力を弱め塩化ナトリウムなどのイオン結晶の結合格子を破壊して溶解させる、すぐれた「溶媒」として働きます。複数の水分子の間では水素原子と酸素原子の間に水素結合を作ります。
水に限らず、最外殻に孤立電子対を持つ窒素や酸素やフッ素などの原子やイオン、あるいは電気陰性度が高い原子に結合している水素原子は水分子と水素結合を作ることができます。したがって水は、糖などイオン性ではない分子に対する溶解性も示します。
一方、シクロヘキサン( C6H12)などの炭化水素はイオン性でなく、水素結合も形成しないため、水には溶解せずに寄り集まって油滴を作ります。このように水に溶けない疎水性の化合物同士が水の中で見かけ上親和性を示す現象を「疎水効果」と呼びます。
水の色は一般に無色透明といわれることが多くありますが、実際には水分子の赤外吸収スペクトルが可視領域に裾野を引き、赤色光をわずかに吸収するので、ごくわずかな青緑色を呈します。海などの厚い層を成す水および巨大な氷が青いのはこれによるものです。
地球上には多くの水が存在しており、生物の生育や熱の循環に重要な役割を果たしています。水は強力な水素結合で水分子同士が引き合っているために蒸発潜熱が大きいので、気体である水蒸気は最大の温室効果ガスです。地球における継続的な水の循環は「水循環」と呼ばれ、太陽から与えられたエネルギーを主因として、固体・液相・気相間で相互に状態を変化させながら、蒸発、降水、地表流、土壌への浸透などを経て、地球上を絶えず循環しています。また、この循環の過程で地球表面の熱の移動や浸食、運搬、堆積などの地形を形成する作用が行われています。
地球の水の総量は約14億 Km3=(1.4×1018m3)と言われ、その97%が海水として存在し、淡水は残り3%に過ぎません。地球表面の淡水のほとんどは氷河や氷山として、固体の形で存在しています。氷の状態の淡水の大部分は南極大陸とグリーンランドが占めています。
この中で、淡水湖、河川水、地下水浅(ちかすいせん)が、人間が直接に利用可能な水で、総量の1%未満です。飲料水として利用できる水はさらに少なく。海水は天然および人工の全ての汚れを合わせ高濃度に汚染されているため、水資源としての利用価値はほとんどありません。
古代ギリシアの哲学者、一般に最初の哲学者とされるアナトリア半島西海岸メンデレス川河口付近にあった町ミレトスのタレス(紀元前624~紀元前546年頃)は、万物の根源アルケーを探求する中で「アルケーは水である」と述べたと伝えられています。
同じく古代ギリシアの自然哲学者エンペドクレス(紀元前490~紀元前430年頃)は、基本的な元素を「火・空気・水・土」とし、それの集合や離散によって自然界のできごとを説明する、いわゆる四元素説を唱えました。これは西洋最大の哲学者の一人とされる古代ギリシアの自然哲学者アリストテレス(紀元前384~紀元前322年)に継承されました。
古代インドでも、「地・水・火・風」 およびこれに「空」を加えた五大の思想が唱えられていました。また中国においても、万物は「木・火・土・金・水」の5種類の元素から成るとする五行説が唱えられていました。つまり、洋の東西を問わず、「水」は、基本的な4~5種の元素の1つだと考えられていました。こうした水の理解は、2000年以上、18世紀後半の時点でも、ごく一般的でした。
こうした理解に変化が生じ始めたのは18世紀末です。人類の歴史の中で見ても、ごく最近のことでした。18世紀末に、イギリス人自然哲学者ヘンリー・キャヴェンディッシュ(1731~1810年)が、金属と酸が反応した時に、軽い謎の気体(水素)が発生し、それは簡単に燃えて水になることを発見しました。また、「近代化学の父」と呼ばれるフランス人化学者アントワーヌ・ラヴォアジエ(1743~1794年)が、この燃焼で化合する相手が空気中の酸素であることを確かめました。これによって「水は元素ではなかった」という考え方が登場しました。ただし、ラヴォアジエの実験があっても、人々の考え方が直ちに変化したわけではありません。人々や学者らもおおむね四元素の考え方をそれまでどおり用いていた、と科学史家たちは指摘しています。18世紀までの文献に現れる「aqua」「water」「水」などは、基本元素としての水であると理解するのが妥当でした。
19世紀初頭、イギリス人の化学者で物理学者のジヨン・ドルトン(1766~1844年)が実験の結果、水素と酸素が重量比「1:7」で化合するとし(後に正しくは「1:8」と判明)、1805年にはフランス人の化学者で物理学者のジヨセフ・ルイ・ゲイ=リュサック(1778~1850年)とドイツ人博物学者アレクサンダー・フォン・フンボルト(1769~1859年)が共同で、体積比「2:1」で化合することを見出し「2種以上の気体が関与する化学反応について、反応で消費あるいは生成した各気体の体積には同じ圧力、同じ温度のもとで簡単な整数比が成り立つ」という気体反応の法則を発表しました。さらに1811年に、イタリア人の物理学者で化学者のアメデオ・アヴォガドロ(1776~1856年)が分子説を唱え、その枠組みの中で水の分子が「H2O」と定められました。
この19世紀の初頭に、西欧の学者たちの水の理解が変わったと科学史家らによって指摘されていて、同世紀を通して一般の人々の理解も変化していったと考えられています。
分子説の成立と共にあったという点などで、水は近代化学の発展のきっかけを作った物質でした。この時期は、おおむね哲学(philosophia)を母胎として科学(scientia)が生まれつつあった時期と一致しています。こうした新しい独特の哲学を行う人の数が徐々に増え、彼らが自分達のことを他の哲学者と区別するために科学者(scientist)という用語がイギリス人の科学者で科学史家のウィリアム・ヒューウェル(1794~1866年)によって1833年に造語とされ、その使用が提唱されました。
水は生活において大変手頃で重要な存在だったので、かつては単位の基準として重要な役割を果たしていました。日常生活においては高い精度は問題にされないので、温度や純度をあまり気にせず水1cm3が1gとして便利に使われたり、「比重が1よりも大きい物質は水に沈み、1よりも小さい物質は水に浮く」と言われるなど、生活に密着した基準として水は重要な存在でした。
温度の単位である「セルシウス度」の歴史的な定義は、標準大気圧(1気圧)の下での水の融点と沸点をそれぞれ0℃ および 100℃とする切りのよい値でした。しかし現在は、熱力学温度(絶対温度)の単位であるケルビン(K)を「ボルツマン定数」とすることによって定まる温度でセルシウス度の目盛りを定義したことにより、セルシウス温度はケルビンで表した熱力学温度の値から「273.15」を減じた値で表します。従って、水の融点と沸点は、現在の定義では、それぞれ融点0.002519℃(273.152519K)、沸点99.9743℃(373.1243K)となりました。
国際度量衡委員会(CIPM)はSI基本単位の定義を改訂し、国際単位系は2019年5月20日よりそれまでの人工物による定義から全面的に解放され、より根源的な自然の事象の間になりたっている、再現性のある自然法則に基づく定義に移行されました。
それ以前は、水蒸気、水、氷が共存する温度、圧力である水の三重点の熱力学温度の「1/273.15」がK(ケルビン)と定められていましたが、SI基本単位の再定義により、現在ではケルビンは熱力学および統計力学において定義される、系の状態だけで一意的に決まり、過去の履歴や経路には依存しない物理量で、示量性の状態量であるエントロピーと状態数を関係付ける物理定数であるボルツマン定数によって定義されています。
ボルツマン定数は、気体定数をアボガドロ定数で割った値、つまり、理想気体だけでなく、実在気体や液体における物質量を表すときにも用いられる分子1個あたりの普遍定数である気体定数です。ボルツマン定数という名前の通り、統計力学の発展と熱力学第二法則の統計的な説明に寄与したオーストリアの物理学者ルートヴィヒ・ボルツマン(1844~1906年)にちなんで名づけられた定数です。
2019年5月20日に施行されたSIの定義で、ボルツマン定数の値は正確に「K=1.380649×10-23JK」となりました。
1g(グラム)のもともとの定義は、「4℃のときの1cm3の水の質量」でした。従って、論理的な帰結として「水 1cm3 は1g」すなわち「水1000cm3つまり1Lは1kg」と決まっていました。
しかし、水に質量の基準として高い精度を要求するとなると、必然的に高純度の水、高精度に測定された体積、圧力、温度が要求されることになり、これらはいずれも技術的に困難です。このため、1870年代に製作された国際キログラム原器を1キログラムと定義したという歴史的経緯があります。
国際キログラム原器以前は、密度(g/cm3) と比重が完全に一致していましたが、国際キログラム原器による定義を境に一致しなくなりました。
現在では、水が最大密度となる「3.984℃のときの1cm3の水の質量は、0.99997495g」と定められています。なお、2019年に施行されたSI基本単位の再定義では、国際キログラム原器は廃止され、キログラムは光子のもつエネルギーと振動数の比例関係をあらわす比例定数である「プランク定数」によって定義されています。プランク定数は、黒体放射を説明するプランクの法則を発見した、量子力学の創始者の一人であるドイツ人物理学者マックス・プランク(1858年~1947年)にちなんで命名され「h=6.62607015×10-34J・s」と定義されました。
プランク定数に基づく定義では、「静止エネルギーと質量の関係式[E=mc2]を用いて、ある振動数[ν] の光子のエネルギー [E=hν]と等しい静止エネルギーを持つ物体の質量は1キログラム」と定義されました。
すなわち、「キログラムは周波数が{(299792458)2/6.62606957}×1034 ヘルツの光子のエネルギーに等価な質量」となります。
熱量の1cal(カロリー)の元々の定義は、「1gの水を1℃(1Kの温度差)上げるのに必要な熱量」でしたが、現在では、カロリーはジュール(J)によって直接に定義されています。
1ジュールは「標準重力の下で102.0グラムの物体を1メートル持ち上げる時の仕事量」または、「1ボルト(V)の電圧の中で 1クーロン(C)の電荷を動かすのに必要な仕事量」に相当すると定義され、日本の計量法体系では、「1cal=4.184J」と定義されています。
しかし、SI基本単位の定義をより根源的な自然の事象の間になりたっている、再現性のある自然法則に基づく定義に移行された後も依然として、水は生活において手頃な単位の基準として重要な存在のままです。
ところで、ジハイドロゲンモノオキサイド(一酸化二水素、略称DHMO)は、私たちの身のまわりに気体、液体、固体の状態で多量に存在している、無色で無味・無臭の化学物質です。DHMOとは水「H2O」のことです。水分子は水素原子2個と酸素原子1個が結びついているので、ジハイドロゲンモノオキサイド(一酸化二水素)と呼びます。
余談ですが、1997年に米国アイダホ州の中学生ネイサン・ゾナーが「ジハイドロゲンモノオキサイドの使用を禁止せよ」という嘆願書を作成し、街頭で非日常的な科学技術用語を用いてDHMOを解説し、毒性や性質について否定的かつ感情的な言葉で説明を加えたのち、署名を集めました。
その内容は、「DHMOは、今日アメリカの、ほとんどすべての河川、湖および貯水池で発見されている。さらに、DHMO汚染は全世界に及んでいて、南極の氷からも発見されている。政府はDHMOの製造、拡散を禁止することを拒んでいる。今からでも遅くない、さらなる汚染を防ぐために、いま、行動しなければならない」というものでした。そして、通行人50人のうち43人の署名を得ました。ゾナーが行った「人間はいかにだまされやすいか?」の調査は、地元の科学展で優秀賞を受賞して話題になりました。
これは、「水」といわずに化学物質の「ジハイドロゲンモノオキサイド」という一見難しそうな、恐ろしげな名前にしたことで、コロリと騙されてしまう人の多さに警告を鳴らしたものでした。「化学物質」というだけで「恐ろしい物質」というイメージを持った人が多いようです。
文献:
ウィキペディア・フリー百科事典
「水」「電気双極子」「水の性質」「カルコゲン」「オキシダン」「タレス」「エンペドクレス」「四元素説」
「アリストテレス」「五行説」「ヘンリー・キャヴェンディッシュ」「アントワーヌ・ラヴォアジエ」
「ジヨン・ドルトン」「ジヨセフ・ルイ・ゲイ=リュサック」「アレクサンダー・フォン・フンボルト」
「気体反応の法則」「アメデオ・アヴォガドロ」「分子説」「ウィリアム・ヒューウェル」「セルシウス度」
「マックス・プランク」「DHMO」
2025年4月2日
「化学の泉」投稿文(その39)/豆知識(はじまりシリーズ)
【免疫の歴史】
免疫は、感染、病気、あるいは望まれない侵入生物を回避するために十分な生物的防御力を持っている状態を指す言葉です。
生物の体は複雑精妙にできています。病原体などの外敵が侵入すれば病気になりますが、ムザムザとやられっぱなしになっているわけではありません。外敵を迎え撃ち、返り討ちにするシステムを備えています。このシステムが「免疫」で、免疫は何重にも張り巡らされた精巧な防御システムです。
免疫システムを構築するのは「免疫担当細胞」といわれる特殊な細胞群です。免疫担当細胞は血液やリンパ液中に存在します。一般に「白血球」と呼ばれるものが免疫担当細胞です。白血球のうち、最も多いのは「顆粒球」であり、全白血球の50~70%を占めます。さらに顆粒球の90~95%は「好中球」です。
外部から生体内に侵入して害をなすものを一般に「抗原」といいます。それに対して抗原につけるレッテルを「抗体」といいます。そして抗体を手掛かりに抗原を攻撃するのが免疫担当細胞です。
抗原が侵入すると免疫担当細胞が抗体を分泌し、それが抗原に結合します。この反応を「抗原―抗体反応」といいます。その結果、生成した結合体を「抗原―抗体複合体」といいます。
好中球は、盛んな遊走運動(アメーバ様運動)を行い、生体内に侵入してきた細菌や真菌類を飲み込むことで貪食殺菌を行います。飲み込まれた細菌類は、好中球の細胞内器官である生体膜につつまれた構造体で細胞内消化の場であるリソソーム(ライソゾーム)で消化されます。消化された細菌類の生体高分子は、リソソーム内部の加水分解酵素で加水分解されます。このように貪食殺菌することで好中球は、感染を防ぐ役割を果たします。好中球は、抗原(外敵病原体)の種類に関係なく、抗原さえ見れば見境なく、何でも貪食するので「食細胞」とも呼ばれます。
細菌や真菌などの感染には好中球が最初に集結して対処します。しかし、好中球は体液性免疫細胞への抗原提示は行いません。好中球が処理し切れなかった細菌などの異物は、生体内をアメーバ様運動する遊走性の食細胞マクロファージなどが貪食して抗原提示を行い、体液性免疫を獲得します。
免疫系は血液成分の働きですから、血液が届くところなら体中のどこにでも存在します。しかし、免疫系が主に働く臓器があります。それは「腸管」です。多くの病原体は口から入り、腸管を通して体内に侵入します。これらの侵入物から身を守るために、腸管には免疫担当細胞の60%以上が存在しているといわれます。
B細胞の働きは抗原に抗体を張り付けることです。抗体というレッテルの付いた抗原は、食細胞に食べられてしまいます。このような免疫機構は、主役の抗体が血漿(けっしょう)などの体液中に存在するので特に「体液免疫」といいます。抗体を介して抗原と結合したB細胞は形質細胞となって、同じ抗体を大量に生産します。
通常、B細胞が形質細胞に変化し、特定の抗体を生産するようになるには7~10日程度の期間を必要とします。しかし、一度できた形質細胞は病気が治ったからといって消えてなくなるわけではありません。抗原が消失してしまった後も、形質細胞は体内に残留し続けます。そして、次に同じ抗原が侵入してきたときには、この形質細胞が直ちに大量の抗体を生産し、抗原を攻撃します。これがアレルギーの原因であり、酷いときにはアナフィラキシーを発症させます。コソ泥の侵入に軍隊が立ち向かうようなもので、戦場となった生体はたまったものではありません。
T細胞は抗原体をライフルで狙い撃ちするスナイパ-(狙撃手)のような細胞です。T細胞にはいくつかの種類がありますが、最も凄いのはキラーT細胞です。
キラーT細胞は、レッテル(抗体)を貼った細胞なら、病原体はもちろん、癌細胞などにも入り込み、破壊し、殺すことができる強力細胞です。このような免疫は免疫担当細胞によるものなので「細胞性免疫」といいます。
適応免疫は、しばしば免疫がどのように誘導されるかに依存して2つの主要な型に分けられます。自然獲得された免疫は、病気を起こす病原体との接触で生じ、この場合病原体との接触は故意ではありません。これに対して人為的獲得免疫は、ウイルス接種のような意図的な行為によってのみ発達するものです。自然獲得免疫も人為的獲得免疫も免疫が宿主に誘導されるかあるいは免疫された宿主から受動的に移動するかによってさらに分けられます。受動免疫は免疫をもった宿主から抗体や活性化T細胞を移動して付与されます。有効なのは短期間で普通数ヶ月しか続きません。一方能動免疫は宿主体内に抗原によって誘導され、最も長期間続いた時には生涯にわたります。
適応免疫のより細かい分類は関与する細胞の特徴で決まります。体液性免疫は分泌された抗体で媒介されますが、細胞性免疫で提供される防御はT細胞のみです。体液性免疫は生体が自分自身の抗体を産生するとき能動的であり、他の人間から抗体を移すときは受動的です。同様に細胞性免疫では生体自身のT細胞が刺激されるとき能動的で、他の生体からT細胞をもって来るときは受動的です。
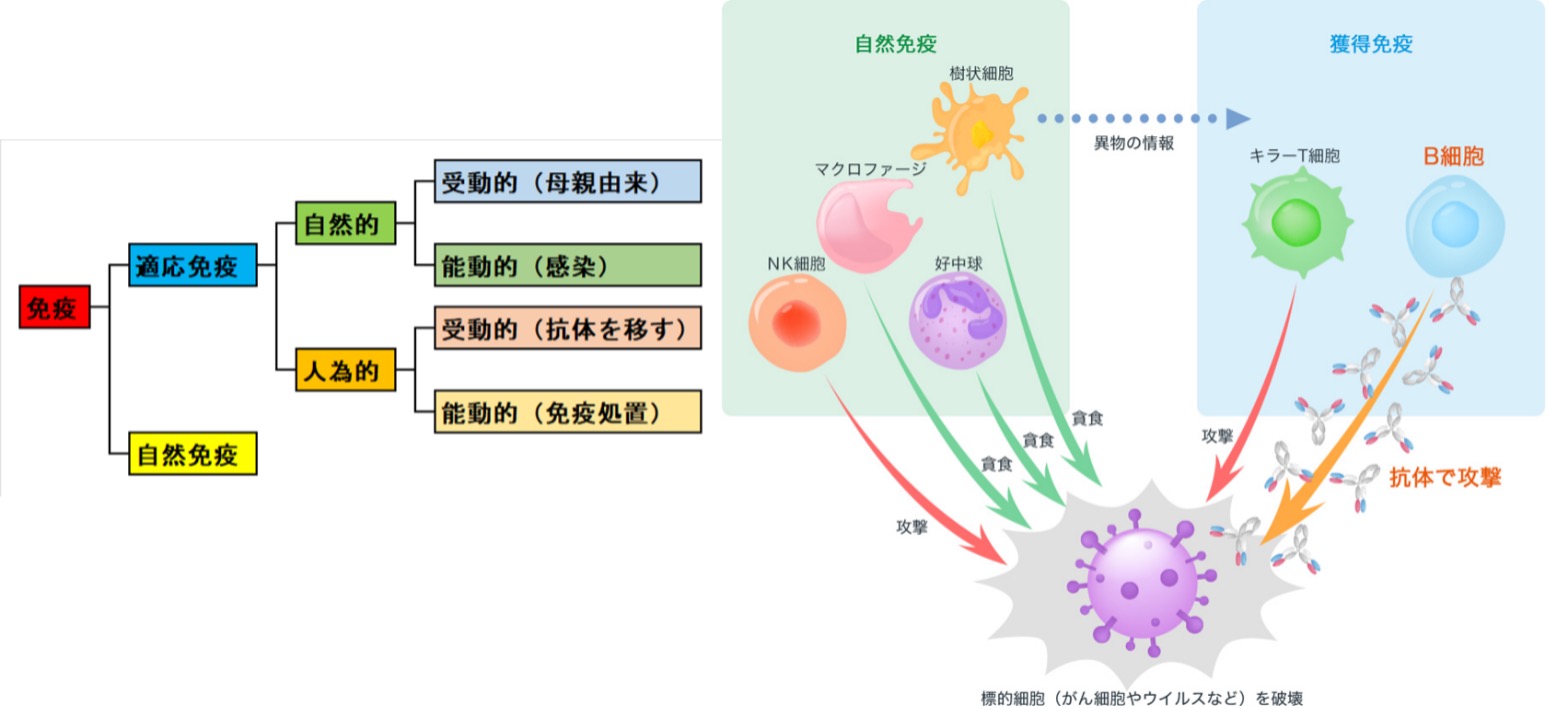
免疫の概念は数千年の間人類の興味を引いてきました。前史時代の病気に対する考えは、超自然的な力が原因で、神あるいは敵のそばで魂を探し求めてきた、悪い行いや悪魔の考えを神が罰する形が取られたものとされていました。古代ギリシアの医師ヒポクラテス(紀元前460~紀元前370年)の時代から19世紀までの間で科学的方法の基礎が作られ、4つの気質「血、粘液(痰)、黄色胆汁、黒色胆汁」の1つが変化するか、またはこれらのバランスが崩れることで病気を引き起こすきっかけになると考えられました。 この期間に人気があったのは、ある種の病気を引き起こすと考えられた「悪い空気」、つまり瘴気論(しょうきろん)です。コレラや黒死病は「悪い空気」の有毒な形である瘴気によって起こるとされ、誰でも瘴気に接触すると病気に罹ると考えられました。
瘴気論は、古くは、古代ギリシアのピポクラテスが提唱しています。彼によると、病気は「悪い土地」「悪い水」「悪い空気」などにより発生し、「悪い空気」、つまり瘴気は、「悪い水」、つまり沼地や湿地から発生し、人間がこれを吸うと体液のバランスを崩し病気になり、こうして病気になった人間も瘴気を発し、周囲の人間を感染させると唱えました。
瘴気論は、病気の原因は呪いや祟りだとするような考えよりは、物理的な外因を想定している分、かなり前進しています。マラリアを媒介する蚊は「悪い水」で繁殖するため、「悪い水」の近くにいるとマラリアに罹りやすいというのは事実であり、それから推論し、一般化した考えだとみなすこともできます。中国でも遅くとも唐代(618~907年)には、「悪い水」が瘴(マラリア)の原因らしいと認識されていたようです。
17世紀、イングランド国王のイギリス人医師トマス・シデナム(1624~1689年)は、瘴気が起こす病気として天然痘、赤痢、敗血症、ペストなどを挙げました。また彼は、瘴気は地球内部から発生すると主張しました。
19世紀、救貧法と公衆衛生の改革を行ったイギリス人社会改革者エドウィン・チャドウィック(1800~1890年)は、瘴気論を根拠に下水道の整備を訴えました。また、19世紀アメリカ人医師ジョン・ゴリー(1802~1855年)は、空気中の瘴気を除去するために、氷冷式エアコンを発明し病院に導入しました。「悪い水」や「悪い空気」が病気の原因だという考えは原因と結果だけ見ればそう間違っていなくて、公衆衛生においては一定の成果を上げたといえます。
一方、瘴気論を否定する考えもありました。古代共和政ローマの政務官マルクス・テレンティウス・ウァッロ(紀元前116~紀元前27年)は、瘴気とは気体ではなく微小な動物だと主張しました。これはマラリア媒介蚊のことだと解釈すれば、真実を言い当てています。しかしこの考えは瘴気論の主流とはなりませんでした。
16世紀、伝染病の「接触伝染説(コンタギオン説)」を提唱したイタリア人科学者ジローラモ・フラカストロ(1478~1553年)は、病気が伝染する原因は、微小な生物である「生きた接触体(contagium vivim)」との接触(コンタギオン、コンタジョン)だと唱えました。彼の主張は、「生きた接触体」の正体が未知であることを除けば、現在の病原体に対する理解と変わらないものでした。
その後、1674年に歴史上はじめて顕微鏡により微生物を観察し、「微生物学の父」とも称せられるオランダ人の商人で科学者のアントニ・ファン・レーウェンフック(1632~1723年)が、微生物こそが「生きた接触体」ではないかと推測しました。
フランス人の生化学者で細菌学者のルイ・パスツール(1822~1895年)は細菌による発酵と腐敗を研究した結果、「生きた接触体」の正体は細菌だとする説を主張しました。
1876年、ドイツ人の医師で細菌学者のロベルト・コッホ(1843~1910年)が、ヒツジやヤギなどの家畜や野生動物の感染症で、ヒトに感染することもある人獣共通感染症である炭疽症(たんそしょう)の病原体と推測されていた炭疽菌が実際に病原体であることを、実験で証明しました。
パスツールとコッホは共に「近代細菌学の開祖」とされています。その後も次々と感染症の病原体が発見され、瘴気論は否定されました。
近代的な言葉「免疫(immunity)」はラテン語のimmunisに由来します。兵役サービス、納税、あるいは他の公共へのサービスからの免除を意味しています。書いた記録に「免疫」概念が最初に現れるのは、紀元前430年に、古代アテネの歴史家トゥキュディデス(紀元前460~紀元前395年)が「病人や死にそうな人は病気から回復した人々によって手厚く看護された。なぜなら彼らは病気の経過が分かっており彼ら自身はもう心配はなかったから。そして以前病気に罹ったものは、二度と罹らず死ぬことはない」と記録しています。免疫(immunes;病気や毒に対する免疫性)なる言葉が紀元60年頃、ローマ帝国の詩人マルクス・アンナエウス・ルカヌス(39~65年)によって詠まれた叙事詩『ファルサリア』中にも見受けられます。彼は北アフリカ部族の蛇毒抵抗性を描写しました。
特定の病気の病原体によって引き起こされる免疫(immunity)についての記述が最初に臨床的な視点で記録されたのは、おそらくペルシャの錬金術師で医者のアル・ラーズィー(865~925年)によって書かれた「天然痘および麻疹(ましん;はしか)についての論文(Kitab fi al-jadari wa-al-hasbah、翻訳1848年)」でしょう。論文中に、彼は天然痘と麻疹の臨床描写を行い、免疫(immunity)と言う言葉を使わなかったものの、これらの特定の病気を起こすものに接触すると長続きする免疫(immunity)がつくことを示しました。 しかし誕生後間もない科学である免疫学が、いかに細菌が病気を起こすか、そして感染後いかに人の体がさらに障害を受けないよう抵抗力を獲得するのかの説明を始めるまで、パスツールによる病気の病原体説まで待たなければなりませんでした。
受動免疫による治療は、共和政ローマの東方における覇権に挑戦し、3次にわたって戦火を交えた小アジアにあったポントス王国の国王ミトリダテス6世(紀元前132~紀元前63年)に始まるでしょう。彼は毒に対して自身を強固にしたいと思い、抵抗力を付けるために毎日致死量以下の毒を飲みました。ミトリダテスは地球上のあらゆる毒から身を守るために宇宙の解毒者になるとも言いました。 約2000年近くの間毒は病気の原因に最も近いものと考えられ、ルネサンス時代は様々な物質の複雑な混合物、これはミトリデイトと呼ばれましたが、それが中毒の治癒に用いられました。 この治療法の改良版は『Theriacum Andromachi』で、19世紀までよく用いられました。1888年、フランス人の免疫学者で医師のエミリー・ルー(1853~1933年)とスイス系フランス人の細菌学者で医師のアレキサンドル・イェルサン(1863~1943年)はジフテリア菌毒素を単離し、そして1890年にドイツ人の医師で実業家のエミール・アドルフ・フォン・ベーリング(1854~1917年)と日本人の微生物学者で医師の北里 柴三郎(1853~1931年)によってジフテリアと破傷風に対する免疫に基づいて抗毒素が発見された後、抗毒素が近代治療免疫学の主要で最初の成功となりました。
19世紀に入るとヨーロッパでは能動免疫の導入が始められ、その試みに天然痘が含まれていました。しかしながら免疫処置は少なくとも千年の間様々な形で存在していました。 免疫処置を最初に用いたのは知られていませんが、紀元前1000年頃であり、中国人は天然痘のかさぶたで作られた粉末を乾かし吸い込むというような免疫処置の形となるものを実際に行い始めていました。15世紀頃のインドとオスマン帝国と東アフリカで、天然痘のかさぶたの粒から作った粉末を用いて皮膚を突くことによって、あばたを作ることはごく普通のことになっていました。 このあばた作りは18世紀初めイギリス人の著述家で外交官の妻であったメアリー・ウォートレー・モンターギュ嬢(1689~1762年)によって西洋に紹介されました。1796年、イギリス人の医師エドワード・ジェンナー(1749~1823年)は死んでいないウイルスだが天然痘に対する免疫を誘導する牛痘を用いたより安全な接種法を導入しました。ジェンナーの天然痘ワクチンのメカニズムを科学的に分析したのが、パスツールでした。パスツールは弱毒化した微生物の接種により、免疫を得ることができることを解明しました。
ジェンナーの取ったやり方の成功とそれが一般的に認められたことは、その後19世紀終わりにワクチン接種の性質の一般性がパスツールによって導き出され発展したことへつながりました。
人為的獲得能動免疫は抗原を含んだ物質であるワクチンによって誘導できました。ワクチンは抗原に対する初期応答を刺激し、病気の症状は起こしません。 ワクチン接種という言葉はジェンナーが考えだし、ワクチン接種における開拓者的研究を考慮して、パスツールもそれに合わせました。パスツールの用いた方法は、それらの病気の感染性病原体に対し、それらの病原体が重大な病気を起こす能力を失うような処理をする必要がありました。パスツールはジェンナーの発見に敬意を表してワクチンという名称を一般名として採用しました。パスツールの研究はジェンナーの上に構築されました。
1807年、南ドイツのバイエル人たちが、兵役動員のために必要な、天然痘に対するワクチン接種の最初のグループとなりました。天然痘の広がりが戦闘に関与していたため、 その後の戦争の広がりとともにワクチン接種の施行は増えて行きました。
伝統的なワクチンには4型があります。「不活性化ワクチン」は化学薬品や熱処理で殺された微生物からなり、もはや感染性はもちません。例は、インフルエンザ、コレラ、腺ペスト、A型肝炎の各ワクチンです。コレラの型のワクチンの大部分は追加免疫が必要かも知れません。
「生きた弱毒ワクチン」は、病気を起こす力をなくす条件で培養した微生物からなります。これによる応答は持続性があり一般に追加免疫は不要です。例は黄熱病のほか、麻疹、風疹、おたふく風邪の各ワクチンです。
「類毒素(トキソイド)ワクチン」は、病原体が分泌する毒素をホルマリンなどで処理することにより、免疫原性を有した状態で微生物の毒素を不活性化した物質です。微生物が病気をもたらす場合、病原体が分泌する毒素に出合う前に用います。この例は破傷風とジフテリアの各ワクチンが含まれます。
「サブユニットワクチン」は、ウイルスなど病気起因性の病原体から特定のタンパク質を単離し、これを単独で投与するものです。単に抗原が病原体の断片なので不活性ワクチンと同様に、ワクチンは完全に「死滅」しているため、感染性はもちません。この例はB型肝炎ワクチンです。
大部分のワクチンは消化管からの吸収はあまり期待できないので皮下注射で行われます。ポリオ、腸チフス、およびコレラの弱毒生ワクチンは、腸をベースとした免疫を付与するため経口的に与えられます。
1889年、北里柴三郎は破傷風菌の毒素を無力化する抗体を発見し、血清療法を確立しました。そしてワクチン接種により、生体が獲得する免疫の正体が血中タンパク質の抗体によるものであることを突き止めました。
また、ロシア人の微生物学者および動物学者であるイリヤ・メチニコフ(1845~1916年)は免疫の本質が血液中の食細胞と生体防御の双方の働きにあると考え、1908年、食菌作用の研究でノーベル生理学・医学賞を受賞しました。
B細胞の不思議なところは、どのような抗原に対してもピッタリとフィットする抗体をつくることです。その種類は100億を超えるといわれ、この「抗体多様性の謎」は、北里の時代から未解決のままでした。
この問題を解決したのがマサチューセッツ工科大学教授で日本人生物学者の利根川 進(1939~ )でした。利根川の発見は「遺伝子が変化する」というものでした。
遺伝子情報はDNAに書き込まれており、一生その形は変わらないため、指紋のようにその人を特定する決め手になると考えられています。しかし、利根川は「B細胞だけは自らの抗体遺伝子を自在に組み替えて、無数の遺物に対する無数の抗体をつくることができる」ことを証明したのでした。
1987年ノーベル生理学・医学賞の受賞が決まったとき、先輩の研究者から届いた一通の祝電を、利根川はいまも記憶しているといいます。電報には、「北里が始めたことを、君が完結させた」と書かれていました。ジェンナーの種痘に始まった免疫学は現在も幅広く発展し、生命現象を理解するだけでなく、人々を伝染性疾患から守る砦としてなくてはならないサイエンスに成長しています。
2019年、中国の武漢で発生した新型コロナウイルス(covid-19)は瞬く間に世界中に拡散し、WHOは2020年3月にパンデミック(世界的蔓延)を宣言しました。その後も新型コロナウイルスの勢いは衰えることなく、α株、β株、γ株、ο株と変異を繰り返し、その感染強度を高めていきました。
一般にウイルスには効果的な薬が少ないのが実情です。細菌には良く効く抗生物質も、生物でないウイルスには細胞膜が無いために効果がありません。そのため、あと頼れるものは「ワクチンによる予防」だけですが、一般に新しいワクチンを開発するには通常10年は掛かります。しかし、ご承知の通り、新型コロナウイルス用のワクチンは発生から1年半という短期間で開発されました。しかも大量生産することで、世界中でワクチン接種が行われました。
その秘密は「mRNA(メッセンジャーRNA)ワクチン」という、これまでに使われたことのない新型ワクチンが関係しています。
核酸にはDNA(デオキシリボ核酸)とRNA(リボ核酸)があります。DNAは母細胞から送られた遺伝子情報であり、RNAはDNAを受け取った娘細胞が、DNAを基にして自分でつくった核酸です。
DNAは遺伝子情報だといわれるものの、実際に遺伝に使われる遺伝子部分は全体のわずか5%程度といわれています。他の95%はジャンク(ガラクタ)DNAと呼ばれています。RNAはこの遺伝子部分だけを綴り合わせた核酸です。
娘細胞が活動を始めてから自前で独自のタンパク質を合成する場合、表に立って活躍するのはDNAではなくRNAのほうです。RNAにはいくつかの種類があり、なかでもよく知られているのはメッセンジャーRNA(mRNA)とトランスファーRNA(tRNA)です。
mRNAは遺伝子を綴り合わせた核酸であり、DNAの重要部分を持っている実質的なタンパク質の設計図です。それに対してtRNAはタンパク質の製造工場にタンパク質の原料であるアミノ酸のうち、mRNAに指示されたものを持っていく、アミノ酸の運搬係です。
mRNAワクチンとは、mRNAを利用して免疫反応を起こすワクチンのことをいいます。通常のワクチンは、病原体を弱めた「生ワクチン」やその死骸「不活化ワクチン」、あるいは病原体が分泌する毒素「トキソイドワクチン」を使います。それに対し、mRNAワクチンの本体は化学的に合成されたmRNAの分子です。
これが生体の細胞内に入ると、ワクチンのmRNAは細胞に作用することで、本来は抗原の新型コロナウイルスによって産生されるはずのタンパク質を細胞につくらせます。つまり、mRNAは細胞自身に抗原をつくらせるのです。
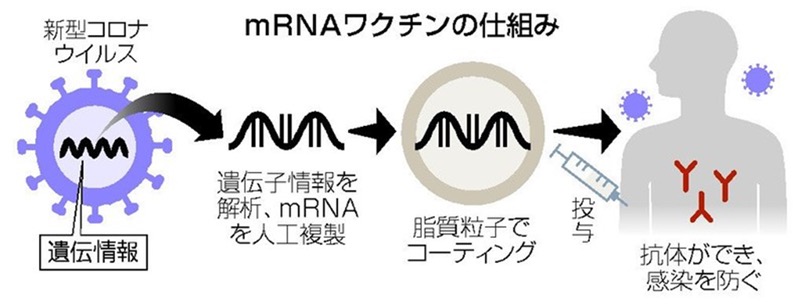
誰がつくろうと抗原は抗原ですから、生体の免疫系はこの抗原に対抗する抗体をつくり、免疫体制を整えることになります。これがmRNAワクチンの機能です。
mRNAワクチンの利点は、化学合成によってつくられるという点にあります。発酵などのように、微生物に任せるのではなく、100%人工合成によってつくられることで、設計も生産も人間がコントロールできます。そのため、ワクチンの生産速度の加速や生産コストの低減が可能で、細胞性免疫と体液性免疫の両方を誘導することができます。しかし、mRNA分子は壊れやすく、極低温下での保存と流通が必要です。
このmRNAワクチンの誕生は、ワクチンの勝利といってもよいのではないでしょうか。ジェンナー以来200年の歴史を持つワクチンがまったく新しく変化したのです。人類はまた一つ、病魔に対する有効な手段を手に入れたのです。
文献:
ウィキペディア・フリー百科事典
「免疫」「免疫担当細胞」「白血球」「顆粒球」「好中球」「貪食殺菌」「リソソーム」「抗原」「抗体」「B細胞」
「体液免疫」「T細胞」「細胞性免疫」「自然獲得免疫」「人為獲得免疫」「受動免疫」「能動免疫」
「ヒポクラテス」「瘴気論」「トマス・シデナム」「エドウィン・チャドウィック」「ジョン・ゴリー」
「マルクス・テレンティウス・ウァッロ」「感染症の歴史」「ジローラモ・フラカストロ」
「アントニ・ファン・レーウェンフック」「ルイ・パスツール」「ロベルト・コッホ」「トゥキュディデス」
「マルクス・アンナエウス・ルカヌス」「アル・ラーズィー」「ミトリダテス6世」「エミリー・ルー」
「Alexandre Yersin」「エミール・アドルフ・フォン・ベーリング」「北里 柴三郎」
「メアリー・ウォートレー・モンターギュ嬢」「エドワード・ジェンナー」「不活性化ワクチン」
「生きた弱毒ワクチン」「トキソイドワクチン」「サブユニットワクチン」「イリヤ・メチニコフ」「利根川 進」
「mRNAワクチン」「DNA」「RNA」「mRNA」「tRNA」
2025年3月4日
「化学の泉」投稿文(その38)/豆知識(はじまりシリーズ)
【生化学の歴史】
化学と生物学の下位分野である生化学または生物化学は、生体内および生物に関連する化学的プロセスを研究する学問です。生化学は、生物を形作る巨大な生体高分子、特にタンパク質や核酸の立体構造を研究する「構造生物学」、酵素の構造や反応機構を研究する「酵素学」、生物の生存と機能に不可欠な一連の化学反応である代謝を研究する「代謝学」の3つの分野に分けられます。
20世紀の後半、生化学はこれらの分野を通じて、生命現象を説明することに成功しました。生命科学のほとんどの分野は、生化学的な方法論と研究によって解明され、発展してきました。
19世紀初めまで化学の世界では、生物は無生物が持つ科学法則には従わず、生物のみが新たに生命の分子を作り出す能力を持つと考えられていました。ところが1828年、「有機化学の父」と呼ばれるドイツ人化学者フリードリヒ・ヴェーラー(1800~1882年)が、無機物であるシアン酸アンモニウム[NH4OCN]から有機物である尿素[(NH2)2CO]を人工的に作り出すことに成功したことで、生命原理を覆し、有機化合物が人為的に生成可能であることを証明しました。
「生化学」という用語が初めて使われたのは1882年と見られていますが、一般的には生化学の父と呼ばれるドイツ人化学者カール・ノイベルグ(1877~1956年)が1903年にこの用語を提唱したことがはっきり認められています。
「1.構造生物学」
虫や魚、動物など自発的に動くものを「生命体」といいます。しかし、自発的に動くことができない植物も「生命体」とされています。
物体が生命体であるために満たすべき条件は、生物学によって、単純明快に決められています。第一条件は「自己増殖できること」、第二条件は「自分で栄養を摂取できること」、そして第三条件は「細胞構造を持っていること」です。人間を含めて、動物、植物、微生物はこれらの条件をすべて満たしています。
しかし、ウイルスはDNA(デオキシリボ核酸)やRNA(リボ核酸)の核酸を有し、それを使って増殖しますが、宿主に寄生することで栄養を賄っているため第二条件を満たしません。また、細胞膜を持たず、タンパク質でできたカプシード(容器)の中に核酸を入れているため第三条件も満たしません。従って、ウイルスは生物とは見なされないただの物体にすぎません。核酸は遺伝の本質で、遺伝情報を書いた遺伝の指令書です。
核酸を発見したのはスイス人生化学者フリードリッヒ・ミーシェル(1844~1895年)です。ミーシェルは医療廃棄物である包帯に付着した血液から白血球を集めてその構造を研究していました。生物体の細胞には核が存在しますが、血液細胞で核があるのは白血球だけで、赤血球や血小板には核はありません。
白血球の核の構造を調べているうちに、タンパク質の他にリンを多量に含む物質を発見し、これを「ヌクレイン」と命名しました。ミーシェルはヌクレインの機能を「リンを貯蔵するもの」ぐらいにしか考えていませんでしたが、これこそが遺伝学の発展につながる重要な発見でした。後にヌクレインから核酸が分離され、その成分の詳細が明らかにされました。
アメリカ人生物学者オズワルド・アベリー(1877~1955年)は、肺炎球菌には病原性のものと非病原性のものがあり、非病原性のものが病原性のものに変異する原因物質(遺伝物質)は何かについて研究していました。1943年、その遺伝物質がタンパク質ではなくヌクレインに含まれる核酸、すなわちDNAであることが明らかになりました。
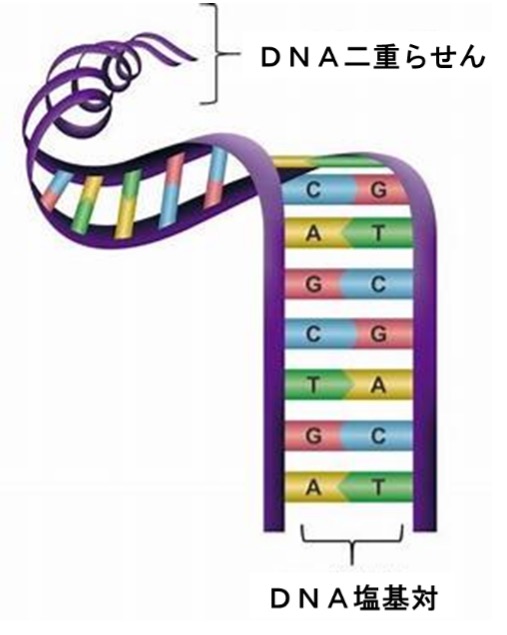
その後、遺伝子の本体であるDNAの構造を明確にするために、多くの研究者が競い合い、DNAとは「A,C,G,T」という4個の記号で表される4種の塩基が固有の順序で結合した高分子で、2本の互いに相補関係にあるDNA高分子鎖からなることが明らかになりました。
1953年、イギリス人分子生物学者ジェームズ・ワトソン(1928年~ )とイギリス人生物学者フランシス・クリック(1916~2004年)が、X線構造解析の手法を用いDNAの二重らせん構造を明らかにしました。しかし、当時はDNAが遺伝物質であることは既に明らかになっていましたが、複雑な遺伝情報を単純な物質であるDNAが担っているという考えには批判が多く、「タンパク質こそが遺伝物質であろう」という意見が根強くありました。その後の研究の進展に伴い、遺伝が二重らせんモデルによるDNAの複製によって起こることや、塩基配列が遺伝子情報を担っていることが説明できるようになり、この考え方に基づきクリックは1958年に遺伝情報が「DNA→(転写)→mRNA(メッセンジャーRNA)→(翻訳)→タンパク質」の順に伝達される、という、分子生物学概念の基礎となる「セントラルドグマ」を発表し、その後の分子生物学の発展に決定的な影響を与えました。1962年にワトソンとクリックは、X線構造解析を担当したイギリス人生物物理学者モーリス・ウィルキンス(1916~2004年)とともにノーベル生理学・医学賞を受賞しました。
セントラルドグマにより、「どのような酵素が存在するかはどのような遺伝子が存在するかということを意味する」遺伝子と酵素との対応関係は明確になり、2003年にはヒトゲノムの解読が完了し、ヒトの細胞内で発現するタンパク質の種類はおよそ2万から2万7千種類程度であると推定されました。
「2.酵素学」
最初に発見された酵素はジアスターゼ(アミラーゼ)であり、1833年にフランス人化学者アンセルム・ペイアン(1795~1871年)とフランス人化学者ジャン・フランソワ・ペルソ(1805~1868年)によるものでした。彼らは麦芽の無細胞抽出液による澱粉の糖化を発見し、生命(細胞)が存在しなくても、発酵のプロセスの一部が進行することを初めて発見しました。また、1836年にはフランス人の生理学者で動物学者のテオドール・シュワン(1810~1882年)によって、胃液中からタンパク質分解酵素が発見されペプシンと命名されました。
1878年、ドイツ人生理学者ウィルヘルム・キューネ(1837~1900年)がこの過程を示す用語として「酵素」を提唱しました。後に、「酵素」はペプシンなどの無生物基質を指す用語として、また「発酵」は生命体が持つ化学活性について用いられるようになりました。
19世紀当時、「有機物は生命の助けを借りなければ作ることができない」とする生気説が広く信じられていた中で、酵母によって糖をアルコールと炭酸ガスに分解する現象を調べていた、近代細菌学の開祖と呼ばれるフランス人の生化学者で細菌学者のルイ・パスツール(1822~1895年)によって、生命は自然発生せず、生命がないところでは発酵(腐敗)現象が起こらないことが示されました。それゆえに、酵素作用が生命から切り離すことができる化学反応(生化学反応)のひとつにすぎないということは画期的な発見でした。
しかし、酵素は生物から抽出するしか方法がなく、微生物と同様に加熱すると失活する性質を持っていたため、その現象は酵素が引き起こしているのか、それとも目に見えない生命(細胞)が混入して引き起こしているのかを区別することは困難でした。
そのために、酵素が生化学反応を起こすという考え方はすぐには受け入れられず、当時のヨーロッパの学会では、酵素の存在を否定するパスツールらの「生気説派」と酵素の存在を認めるドイツ人化学者ユストゥス・フォン・リービッヒ(1803~1873年)らの「発酵酵素説派」とに分かれて論争が続きました。
1896年にドイツ人化学者エドゥアルト・ブフナー(1860~1917年)は、生酵母細胞を伴わずに酵母エキスが糖を発酵させる能力の研究において、生酵母細胞が混合液中に存在しないのにもかかわらず、糖が発酵されることを見出し、発酵を引き起こす酵素をチマーゼと命名しました。最終的に、酵母の無細胞抽出物を用いてアルコール発酵を達成したことによって生気説は完全に否定され、酵素の存在が認知されました。1907年、ブフナーは「無細胞発酵の生化学的研究と発見」でノーベル化学賞を受賞しました。
酵素が生体細胞の外でも機能することが示された後、当時の多くの研究者は、酵素活性がタンパク質と関係があると考えましたが、一部の科学者は、タンパク質は単に真の酵素の運搬体に過ぎず、タンパク質それ自体は触媒能力を持たないと反論しました。しかし1926年にアメリカ人化学者ジェームズ・サムナー(1887~1955年)はウレアーゼという酵素が純粋なタンパク質であることを示し、結晶化に成功し、さらに1937年にカタラーゼという酵素についても同様の成果を得ました。1930年には、アメリカ人生化学者ジョン・ノースロップ(1891~1987年)とアメリカ人生化学者ウェンデル・スタンリー(1904~1971年)が消化酵素であるペプシン、トリプシン、キモトリプシンに関して研究し、純粋なタンパク質が酵素になりうることが証明されました。サムナー、ノースロップ、スタンリーの3人は1946年にノーベル化学賞を受賞しました。
酵素が結晶化可能であることの発見は、X線結晶構造解析による酵素の構造決定に繋がり、最初に構造が決定された酵素は、1965年に発表された、涙、唾液、卵白の中で見つかった酵素で、一部の細菌の被覆物を消化する働きを持つリゾチームでした。リゾチームの高分解能構造の決定は構造生物学と呼ばれる学術分野の夜明けとなり、酵素がどのように働くかを原子レベルで解明する努力が始まりました。
「3.代謝学」
代謝とは、生物の生存と機能に不可欠な一連の化学反応です。代謝の主な機能は大きく3つあり、「食物を細胞プロセスを実行するためのエネルギーに変換すること」、「食物をタンパク質、脂質、核酸および一部の炭水化物の合成に必要な構成成分に変換すること」、そして「代謝廃棄物を排出すること」です。酵素が触媒となるこれらの反応によって生物は成長し、繁殖し、構造を維持し、環境に対応することができます。
代謝の科学研究史は400年に及びます。ヒトの代謝に関する最初の制御実験はイタリア人の医師で生理学者のサントーリオ・サントーリオ(1561~1636年)が行い、自身が食事、睡眠、労働、交接、飲酒、排泄の前後でいかに体重が変化したかを説明し、摂取した食物のほとんどが、サントーリオが「不感蒸泄(ふかんじょうせつ)」と命名した、普段感じることなく発生している発汗などの皮膚や呼気からの水分喪失の過程を経て失われることを見出しました。
20世紀中期以降、生化学は「クロマトグラフィー」やX線が結晶格子で回折する現象を用いて物質の結晶構造を調べる「X線回折」、外部静磁場に置かれた原子核が固有の周波数の電磁波と相互作用する現象を用いて分子の構造や運動状態などの性質を調べる分析方法である「NMR(核磁気共鳴)分光法」、「放射線同位体標識」、「電子顕微鏡法」、原子および分子の物理的な動きのコンピュターシミュレーション手法で生体分子のモデリングに適用されている「分子動力学シミュレーション」などの、新技術の発展と共に著しい前進をみました。これらの技術は多くの生体分子や細胞の解糖系や酸素呼吸を行う生物全般に見られる生命がエネルギーをつくり出すためのシステムであるクエン酸回路(クレブス回路)などの代謝経路の発見や詳細にわたる分析を可能にしました。
現代生化学研究で最も多くの発見をした、ドイツ系ユダヤ人の医師で生化学者のハンス・クレブス(1900~1981年)が、1932年にアンモニアから尿素を生成する「尿素回路」を、1937年にイギリス人生化学者ハンス・コーンバ―グ(1928~2019年)と共同で酸素呼吸を行う生物全般に見られる好気的代謝である「クエン酸回路」や微生物の一部や植物にみられる生化学的代謝である「グリオキシル酸回路」を発見し、代謝の研究に非常に大きな貢献を遺しました。
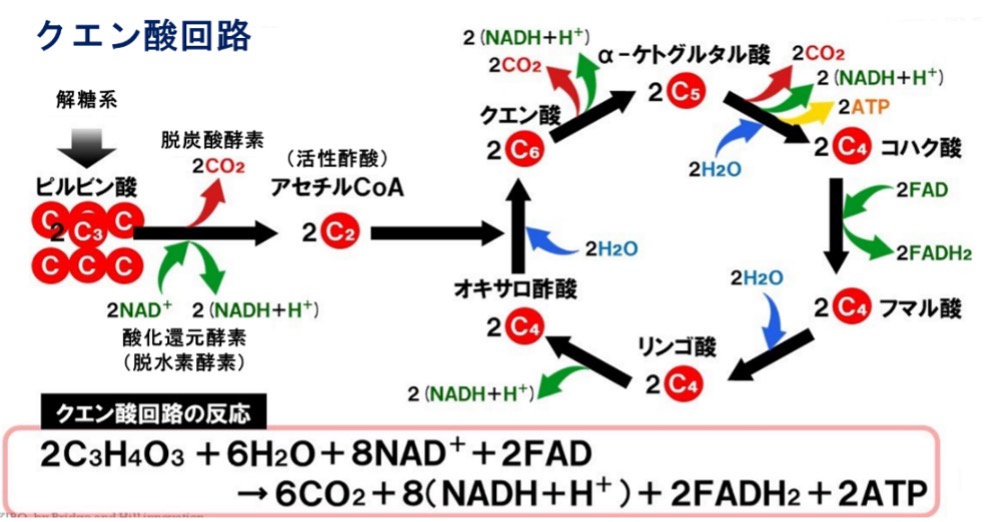
クエン酸回路は、解糖によって生じたピルビン酸や脂質の分解によって生じた脂肪酸などから、電子伝達系で利用可能なNADH(ニコチンアミドアデニンジヌクレオチド)やFADH2(フラビンアデニンジヌクレオチド)を生み出す代謝経路として重要な役割を果たしています。ミトコンドリアのマトリクスでアセチルCoA由来のアセチル基をCO2にまで完全分解する過程でNADHやFADH2などのエネルギーを生み出す回路のことをいいます。ATP(アデノシン三リン酸)とは、すべての植物・動物・微生物の細胞のなかに存在しているエネルギーが蓄えられている物質のことです。NADHとFADH2は、この生化学反応で補酵素の還元体として働き、主な違いは、酸化的リン酸化の際、NADH分子はATPを3分子生成し、FADH2分子はATPを2分子生成します。
今日、生化学の研究結果は、遺伝学から分子生物学に至るまで、また農学から医学に至るまで多くの分野で応用されています。
しかし、生化学(分子生物学)による生命現象の解明で遺伝を司る神秘的な物質が「DNA」という高分子であることがわかると、化学者はこのDNAを改変したらどうなるだろうという、神の領域に踏み込む興味を持つようになりました。
遺伝子を大掛かりに改変するのが「遺伝子組み換え」です。具体的には、Aという生物のDNAの一部を切り取り、それをBという生物のDNAに継ぎ足すことです。これは昔から「交配」と呼ばれた技術です。しかし、交配には限度があり、自然界での遺伝子組み換えに相当する交配は、種を越えて起きることはありません。犬と猫の間に子供が生まれることは無いのです。しかし、遺伝子組み換えを使えば、そのような「限界」はありません。遺伝子組み換えは、蛇と人間のハーフ、馬と人間の異種交配などという、いわゆる「キメラ」を生み出す可能性が有ります。もしキメラが、毒性を持っていて、しかも強い増殖性を持っているとしたら、これは立派な病原体です。まったく新しい伝染性疾患の誕生と言えます。このようなことが起きてしまったら、取り返しのつかないことになります。そこで各国は遺伝子組み換えの利用はもちろん、その実験にも制限を掛け、許可制で許認可し、その制限を超えないように監視しています。
文献:
ウィキペディア・フリー百科事典
「生化学」「構造生物学」「酵素」「代謝」「フリードリヒ・ヴェーラー」「カール・ノイベルグ」
「フリードリッヒ・ミーシェル」「オズワルド・アベリー」「ジェームズ・ワトソン」
「フランシス・クリック」「セントラルドグマ」「モーリス・ウィルキンス」「アンセルム・ペイアン」
「Jean Francois Persoz」「ルイ・パスツール」「テオドール・シュワン」「ウィルヘルム・キューネ」
「ユストゥス・フォン・リービッヒ」「エドゥアルト・ブフナー」「ジェームズ・サムナー」
「ジョン・ノースロップ」「ウェンデル・スタンリー」「サントーリオ・サントーリオ」「ハンス・クレブス」
「クエン酸回路」「NADH」「FADH2」「ATP」「遺伝子組み換え」「キメラ」
2025年2月7日
「化学の泉」投稿文(その37)/豆知識(はじまりシリーズ)
【セラミックスの歴史】
セラミックスまたはセラミックとは、狭義には陶磁器を指しますが、広義では窯業製品の総称として用いられ、無機物を加熱処理し焼き固めた焼結体を指します。焼結は、固体粉末の集合体を融点よりも低い温度で加熱すると、粉末が固まって焼結体と呼ばれる緻密な物体になる現象をいいます。セラミックスは、金属(酸化鉄を主成分とするセラミックス)や非金属を問わず、酸化物、炭化物、窒化物、ホウ化物などの無機化合物の成形体、粉末、膜など無機固体材料の総称として用いられています。伝統的なセラミックスの原料は、粘土や珪石等の天然物です。なお、鉄や銅などの金属粉末を型で圧縮し、融点以下に加熱する焼結プロセスを通じて製造される焼結金属を除き、一般的に純金属や合金の単体では「焼結体」とならないためセラミックスとは呼びません。
セラミックスは元々焼き物という意味です。セラミックスを構成する素材を指す場合にはセラミックと単数形が正しいのですが、今回は無機粉末を焼き固めたものとしてセラミックスも素材のセラミックも区別しないで「セラミックス」と呼称します。
土器は、おもに非常に細かい粒の土である粘土からつくります。粘土は、水を加えて練り合わせると適当な粘り気を持ち、さまざまな形にすることができます。それを火で焼くと粘土粒子の一部が融け、粘土粒子同士が接着して硬くなり土器ができあがります。
セラミックスの語源である「焼き固める」技術が最初に使われたのは、中石器時代(紀元前2万年~紀元前1万2千年頃)の土器の製造でした。日本では一般に、粘土を窯(かま)で焼かず、野焼きによって600~900℃程度で焼いた器を「土器」と称し、主原料に陶土を用い800~1300℃で焼いた「陶器」や主原料に陶石を用い1200~1400℃で焼いた「磁器」と区別しています。人類は火を使うようになると、食べ物を直接火で焼いたり、灼熱した石で焼いたりしました。その後、土をこねて器の形にして焼き固めたものを食物の保存容器として、また、煮炊きの容器として使われるようになりました。煮炊きすることによって、肉などは、やわらかくうま味が出て消化しやすくなり、キノコや堅果・根茎などは渋みやあくが抜け、やわらかくなりました。最も重要なことは病原菌を殺菌できたことでした。土器は、人類最初の「工業製品」とも言えます。土器が発明されたのは、中国江西省では2万年前、極東ロシア、中国南部では1万5千年前のことでした。
日本の焼き物は縄文土器から始まります。およそ1500年前からは「ろくろ」を利用し、窯を使って土器を焼くという技術が中国から日本に入ってきました。約1300年前には釉薬(ゆうやく)を用いるようになり、焼き物に色を付けることができるようになりました。そして、1951年に、焼き物の世界にも工業化の波が押し寄せ、トンネル窯で大量に焼き上げられるようになりました。
世界史で四大文明とは、エジプト、メソポタミア、インド、中国に発祥した古代文明の総称です。それぞれ、ナイル川、ティグリス・ユーフラテス川、インダス川、黄河の大河流域で起こりました。このうち、インダス文明(紀元前3千年~紀元前1千5百年頃)の特徴は、ハラッパー遺跡やモヘンジョ・ダロ遺跡にみられるきわめて綿密に計算された都市計画に基づいた焼成レンガで建てられた建造物群です。
レンガが建築材料として使用されるようになったのはメソポタミア文明の時代からです。紀元前4千年頃からの約千年間は、太陽のもとで乾燥させた日干しレンガが使用されていました。日干しレンガには、風雨にさらされると土に帰ってしまうという欠点がありました。インダス文明では焼成レンガを使っていたので、日干しレンガよりずっと丈夫で、耐水性もありました。インダス文明の滅亡は世界史の大きな謎の一つです。原因には諸説あり、たとえば「膨大な焼成レンガをつくるために過剰に森林が伐採され、大洪水の原因の一つになった」などの自然環境悪化説などがあります。インダス文明の後、インド北部は、アーリア人によるハラッパー農耕文化に変わっていきました。おそらくはインダス文明は完全に途絶えて終わったのではなく、様々な面で後のインド亜大陸の文化の大きな源流となっているのだろうと考えられます。
窯の使用は、焼き物の高温・長時間の焼成を可能にしました。窯は内部を耐火物、外側を断熱材で覆い、物質を高温で加熱できる装置です。焼成温度が高いと、原料の土中の長石や石英などの鉱物が融けて釉薬をかけた状態となり、ガラス質の光沢が出てとても硬くなります。粘土や石英、長石などを原料にして、高温で焼き固めたものが陶磁器といわれます。陶器は「土物」ともいわれ、粘土を原料として比較的低温(800~1300℃)で焼き上げたもので、磁器と比べると密度が低く割れやすいため、肉厚に仕上げられています。表面に釉薬をかけて焼くことが多く、釉薬がかかった部分はガラス質でツルッとしています。素朴で土の質感が残るものが多く、磁器より熱伝導率が低いので熱くなりにくく冷めにくいのが特徴です。
磁器は「石物」ともいわれ、おもに石の粉末を練ったものを原料とし高温(1200~1400℃)で焼き上げたものです。高温で焼くため生地が硬く焼き締まり強度があるため、陶器より薄肉につくることができます。素地が白く表面がなめらかなため、鮮やかで細かな絵付けが映えます。磁器のうち、白磁は中国の南北朝時代の北斉(550~577年頃)に始まり、唐代(618~907年)に発達し、宋代(960~1279年)に最盛期を迎えました。カオリン(白陶土)、石英、長石などを原料にした粘土で、1300℃台の高い温度で焼成してきれいな白色の硬質磁器をつくりました。できあがったものは、強くて、軽くて、透明感を持ち、きわめて滑らかな美しい器になりました。そのため、中国の陶磁器は宋・明・清の時代(960~1912年)を通して重要な輸出品となり、遠く西アジア、ヨーロッパにも運ばれました。特にインド洋を経てイスラム圏に運ばれたルートは「陶磁の道」と呼ばれていました。
ヨーロッパでは、列国の王侯貴族や事業家が、作り出せない硬質磁器の製法をやっきになって見つけだそうとしました。なかでもドイツのザクセン選帝候アウグスト強王(1670~1733年)は、収集した磁器で城館を飾っただけでなく、ドイツ人の錬金術師ヨハン・フリードリッヒ・ベトガー(1682~1719年)を幽閉して、「磁器製法を見つけないと命はない」と命じました。ベトガーはさまざまな白い鉱物で試作を繰り返し、古都マイセン近郊のザイリック鉱山の露天掘りで採掘できるケイ酸塩鉱物の一種であるカオリン[Al4Si4O10(OH)8]を使って、磁器に近いものを作り上げ、1709年には白磁製法を解明しました。こうして1710年に西洋白磁のトップに君臨する、ヨーロッパ初の硬質磁器窯「マイセン」が誕生しました。
1700年代まで、陶工が一つ一つ丁寧に、多彩な色の陶器を手作りでつくっていました。同じものを注文しても、同じ形、同じ色にできる保証はありませんでした。1760年代のはじめに、現在も世界最大の陶器メーカーの一つである「ウェッジウッド社」の創設者で知られる、イギリス人の陶芸家で事業家のジョサイア・ウェッジウッド(1730~1795年)は、発色が安定した、化学的な上質で完全に再生可能な陶器づくりを完成させました。ウェッジウッドの製品は、1766年には、イギリス王室御用達製品としての「クィーンズ・ウェア」の名を与えられ、ヨーロッパ中の王侯貴族を魅了しました。その息子は「進化論」を提唱した自然科学者のチャールズ・ダーウィン(1809~1882年)で、生涯にわたって生活に不自由なく、研究生活に没頭しました。進化論は生物の進化の理解に多大な貢献をし、自然科学に革命を起こすにとどまらず、政治・経済・文化・社会・思想に多大な影響をもたらしました。ウェッジウッドは、言い換えれば、科学や社会の発展に大いに貢献したとも言えます。
セラミックス系接着剤の一つであるセメントは、石灰石、ケイ石、酸化鉄、粘土を細かく粉にして混ぜ合わせ、大きな回転炉で1450℃に加熱して粒状の塊である「クリンカー」にして、それに石膏を3~5%加えて、粉末状に粉砕したものです。これを水で練って固めたものがコンクリートです。エジプトのピラミッド構築(紀元前2600年頃~紀元前300年頃)での石灰セメントの使用が最初といわれています。
古代ローマ時代(紀元前509年~476年)においても、ナポリ郊外のポッツオーリで採掘した、火山によって岩石が高温に加熱され噴気口から出て蓄積していた岩石粉末に石灰と石を混ぜた、火山灰セメントが使われていました。建築後2000年になるパンテオンのドームは、世界最大の無筋コンクリートドームです。しかし、ローマ人がコンクリートを作るのを止めてから1000年以上、コンクリートの建物が建てられることはありませんでした。この技術が失われた理由は現在も謎のままです。
1824年にイギリス人のセメント製造業者ジョセフ・アスプディン(1778~1855年)がポルトランドセメントの特許を取得しました。ポルトランドセメントは、石灰石、粘土、珪酸原料、酸化鉄原料等のセメントの原料を、ロータリーキルン等の焼成窯の中で1500℃程度まで昇温焼成しその後急冷したクリンカーに適量の石膏を混合・粉砕して製造されました。
ちなみに、コンクリートは押しの力には強いが、引っ張りやねじれの力には弱く、建物やダムなどの建築材料には鋼の棒と組み合わせて用いられます。鉄筋コンクリートが使われるようになったのはヨーロッパで産業革命が始まった18世紀中期から19世紀のころでした。
陶磁器、焼成レンガなどの耐火物、セメントなど、天然の鉱物である石や粘土を整形し、窯を用いて高温で焼いた製品全般をセラミックスと呼びます。錆びない、熱に強い、硬い、望む形に作れる、薬品に侵されにくいなどの性質を生かして、多くの物質がセラミックス化されてきました。
最近では精製した原料を用いて耐熱性や硬度以外の新しい性質を備えたセラミックスが、広く使われるようになっています。このため、現在では「非金属の無機材料で製造工程において高温処理を受けたもの」全般をセラミックスと呼ぶようになりました。
19世紀半ばにアメリカ人の発明家トーマス・エジソン(1847~1931年)が電灯を、イギリス人の発明家アレクサンダー・グラハム・ベル(1847~1922年)が電話を発明し、電気の時代と呼ぶにふさわしい時代が訪れ、長い間、「器(うつわ)」として使われてきた「焼きもの」は、その時代にふさわしい新しい役割を果たしていきました。焼きものには電気を通さない性質があります。同じく電気を通さない性質を持つ紙や木材と比べ、焼きものは、気温や湿度といった外的環境が変わっても性質そのものが変化しにくい傾向、つまり、高い信頼性を持っています。また、1万年以上の焼きものの歴史を通じ、さまざまなカタチを実現する造形技術もあります。こうして、焼きものは碍子や絶縁材料など、送電線から家庭で使用するさまざまな製品の部位に至るまで広く使われるようになり、電気を使いやすくするための大切な材料となりました。
20世紀に入るとラジオ放送の開始、テレビ放送の開始、トランジスタの発明などエレクトロニクスの時代を迎え新しいセラミックスが、その時代を支えました。まず使われたのが、20世紀前半の大型真空管用セラミックスです。無線機器に使用され、高い周波数で使用しても高い出力が得られるセラミックスの特性はほかの材料では代替できませんでした。また、材料としてのセラミックスも大きな進歩を遂げました。天然の原料に加えて人工的に合成した原料が使われ始めたほか、金属材料と強固に接合するための技術も開発され、現在のファインセラミックスに大きく近づいて行きました。
エレクトロニクス時代の中核的な部品は「半導体」です。現代の基幹産業と呼ばれる半導体産業を支えたのもセラミックスでした。戦後(1945年以降)すぐにアメリカでトランジスタやICが開発されましたが、当時、外部からの湿気や強い光などに対して極端に弱く、そのままでは産業用に使用することはできませんでした。トランジスタやICの電気的な特性はそのままに、外部からの湿気や光を遮断することができたのが、セラミックパッケージでした。このパッケージがあってはじめて半導体は広く使われるようになったといっても過言ではありません。
電子部品として、コンデンサーやインダクターを小型化したのもセラミックスです。20世紀の半ばから、セラミックスの持つ誘電性や磁性などの特性を大きく改良したセラミックスが次々に開発され、電子部品は急速に小型化、高性能化を図ることができるようになりました。ひいては、電子機器そのものの小型化に、セラミックスはたいへん貢献したと言えます。コンデンサーをセラミックスでつくることがなければ、現在のようなポケットに入るスマートフォンの存在はなかったはずです。今、スマートフォンには1台あたり600個以上のセラミックコンデンサーが使われています。
精選または合成された原料粉末を用いて、管理された工程でつくられる高精度の工業用材料として、従来の焼きものとは一線を画した「ファインセラミックス」がこの時代に誕生しました。なお、高い精度や性能が要求される電子工業などに用いられるセラミックスを、ファインセラミックスと呼び、一般的なセラミックスと区別することがあります。
ファインセラミックスは、原料の種類や合成方法、これまで確立してきた豊富な製造工程などにより、いろいろな特性を創出することが可能です。そのために、エレクトロニクス産業に限らず、多様な産業においても利用することができるようになり、新素材の旗手ともいうべき存在となりました。軽くて剛性が高くかつ薬品などに侵されにくい性質を利用し、数メートルにおよぶ大型サイズのファインセラミックスが半導体製造装置や液晶製造装置に、また、信頼性が高くかつ金属との組み合わせが容易なことから自動車用部品に使用されています。誘電特性や圧電特性を利用した小型で高性能なセラミックコンデンサー、セラミックフィルタやセラミック発振子など多くの電子部品の機能をつくる基盤の材料となっています。ほかにも、磨耗しない性質を生かして繊維産業に使われるなど多くの産業の中の基幹部品としても活躍しています。

私たちの生活の中で、セラミックスとしてすぐ目に付くものは、例えば包丁や皮むき器の刃があげられます。これらは、ジルコニア(二酸化ジルコニウム[ZrO2])を原料とし、ダイヤモンドに次ぐ硬さを持ち、頑丈で粘りのある性質を利用しています。セラミックスの刃のナイフ類は金属製品と比較して錆びにくく、切れ味も長持ちし、食べ物の匂いが移りにくいといった特徴があります。
1888年、ハンガリー人化学者カール・ヨーゼフ・バイエル(1847~1904年)が、ボーキサイトからアルミナを抽出するバイエル法を発明しました。アルミナ(酸化アルミニウム[Al2O3])は、窒化ケイ素[Si3N4]と同様に耐熱性、耐摩耗性、絶縁性といった優れた性質を備えているので、これを利用して、IC基板、切削工具、軸受け、ノズルなどに、窒化ケイ素は自動車のエンジン部品、ベアリング、切削工具などに利用されています。
また、ジルコニアは融点が2700℃と高いため、耐熱性セラミックス材料です。酸素センサーとしてはたらくので酸素濃度の測定に用いられて、自動車エンジンの燃焼の向上、排ガスの浄化の最適な燃焼条件の設定などの用途に利用されています。なお、立方晶ジルコニアは、透明でダイヤモンドに似て高い屈折率を有することから、宝飾品としても用いられています。
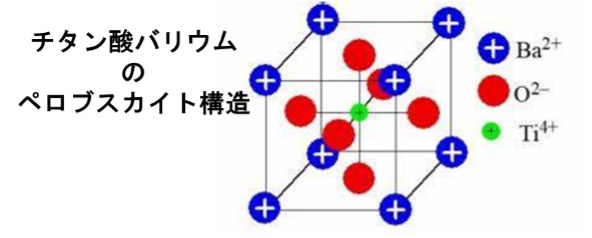
チタン酸バリウム[BaTiO3 ]は、第二次世界大戦(1939~1945年)の最中に、アメリカ、ソ連、日本で独立して発明されました。1942年にアメリカ合衆国のウェイナー(E.Wainer;生没年不詳)とサロモン(A.N.Salomon;生没年不詳)、1944年に日本では逓信省電気試験所の小川建男(生没年不詳)と和久茂(生没年不詳)が、同じく1944年にソビエト連邦のウル(B.M.Vul;生没年不詳)とゴールドマン(L.M.Goldman;生没年不詳)によって、発明されました。立方晶系の単位格子をもち、立方晶の各頂点に金属[Ba2+]が、体心に金属[Ti4+]がそれぞれ位置し、金属[Ti4+]を中心として酸素[O2-]が立方晶の各面心に位置するペロブスカイト構造をもつ人工鉱物で、極めて高い比誘電率を持つことから積層セラミックコンデンサーなどの誘電体材料として広く使用されている代表的な電子材料の1つです。
チタン酸ジルコン酸鉛[Pb(Zr、Ti)O3]は、三元系金属酸化物であるチタン酸鉛とジルコン酸鉛の混晶で、電圧素子や電圧振動子、超音波洗浄機、赤外線センサーに、酸化スズ[SnO2]は可燃性ガスのセンサーとして利用されています。
炭化ケイ素[SiC]は、ダイヤモンドとシリコンの中間的な性質を持ち、硬度、耐熱性、化学的安定性に優れることから、研磨材、耐火物、発熱体などに、また半導体でもあることから電子素子の素材にも使われています。窒化ケイ素[Si3N4]は、優れた硬度、力学的特性からベアリング、タービンブレード、切削工具などに応用されています。
蛍石(フローライト)は、主成分がフッ化カルシウム[CaF2]で、望遠鏡や写真レンズ(特に望遠レンズ)など、高性能化のための特殊材料として現在ではキーパーツとなっています。また、アルミナ、ジルコニア、歯や骨の主成分であるハイドロキシアパタイト(水酸化リン酸カルシウム[Ca5(PO4)3(OH)])などは、バイオセラミックスとして人工関節、人工歯根、人工骨などにも用途が広がっています。
セラミックスは容器の形になっただけで無く、かわら、土管、タイル、レンガなどの建築材料や、台所の流し、トイレの便器などの衛生用にと様々な形になりました。コンクリートをつくるセメントとして、鉄筋コンクリートやダムなど社会の土台にもなりました。そして、高性能のファインセラミックスまで、ずいぶんと進歩しました。今後も様々な種類と用途が研究・開発されていくことでしょう。
加えて、セラミックスは金属やプラスチックと比べると、「最後には土に戻る」という大きな利点があります。製品を壊して、ばらばらにした後に粉砕して粉々にすると、ついには土に戻ります。セラミックスはリサイクルに適しています。
文献:
ウィキペディア・フリー百科事典
「セラミックス」「中石器時代」「土器」「陶器」「磁器」「インダス文明」「煉瓦」
「アウグスト2世 (ポーランド王)」「ヨハン・フリードリッヒ・ベトガー」「マイセン」
「ジョサイア・ウェッジウッド」「チャールズ・ダーウィン」「セメント」「ジョセフ・アスプディン」
「ポルトランドセメント」「トーマス・エジソン」「アレクサンダー・グラハム・ベル」「半導体」
「コンデンサー」「ファインセラミックス」「ジルコニア」「バイヤー法」「酸化アルミニウム」「窒化ケイ素」
「チタン酸バリウム」「ペロブスカイト構造」「チタン酸ジルコン酸鉛」「酸化スズ」「炭化ケイ素」「蛍石」
「水酸燐灰石」
2025年1月1日
「化学の泉」投稿文(その36)/豆知識(はじまりシリーズ)
【分析化学の歴史】
分析化学とは、試料中の化学成分の種類や存在量を解析したり、解析のための目的物質の分離方法を研究したりする化学の分野です。得られた知見は社会的に医療・食品・環境など、広い分野で利用されています。
試料中の成分判定を主眼とする分析を「定性分析」といい、ある試料にどんな成分が含まれているかを調べることです。成分が何であるかを明らかにすることを「同定」といい、化合物の構造決定を行うことも含まれています。
定性分析には、「1.試料に含まれている成分が推定されていてそれを確認する場合」と「2.成分についてまったく情報のない試料に含まれている成分を決定する場合」の2つに大きく分けられます。
「1.」の試料成分が推定されている場合、試料中の成分が、推定される成分に特異的な性質を持つことを確認します。このとき、推定成分の性質を測定するために純粋な推定成分とわかっている試料を使うことがあります。これを標品、標準試料、標準サンプルなどといいます。試料の各種分光法のスペクトルを測定し、標品と同様のピークが見られるか、試料のクロマトグラフィーを行い標品と同じ保持時間で溶出するか、検出試薬と反応させた時に標品と同じように沈殿や呈色(ていしょく)を生じるか、といったことを確認します。物質に赤外線を照射し、透過光あるいは反射光を分光することでスペクトルを得て、対象物の特性を知る「赤外分光法(IR)」、外部静磁場に置かれた原子核が固有の周波数の電磁波と相互作用する現象を用いて分子の構造や運動状態などの性質を調べる「核磁気共鳴分光法(NMR)」、分子をイオン化し、そのイオンが受ける力である質量電荷比(質量mと電荷Zの比;m/Z)を測定することによってイオンや分子の質量を測定する「質量分析法(MS)」、X線が結晶格子で回折する現象を用いて物質の結晶構造を調べる「粉末X線回折法」などのスペクトルは分子構造や結晶構造に極めて特異的であり、既知データとの比較によりそれだけで物質が判明してしまう場合もあります。このような場合は標品の測定を行うことなく、成分の推定と確認の段階を同時に行うことが可能です。
「2.」の試料成分を同定する場合、まず、成分の推定を行い、さらにその推定される成分の特異的な性質を確認します。蛍光X線分析、原子発光分析法などによる元素分析。赤外分光法、磁気共鳴分光法、質量分析法などのスペクトルを測定し、それらから得られた情報と矛盾しない成分を推定します。もし、試料が複数の成分の混合物と考えられる場合には、クロマトグラフィーなどにより、各成分を分離して再び各成分についての推定を行います。そして、推定した成分の標品と同じ特異的な性質が見られるかを確認します。
定性分析は、分析したい対象と同定したい物質分類のレベルに応じて、使われる技術や戦略が異なります。現在の化学の最も基本的考え方では、分子やイオンや結晶単位など一定単位の中の原子の種類と数と配置が同じ試料は同じ種類の物質と見なされます。ゆえに、物質の同定とは、最も詳しいレベルでは分子やイオンや結晶単位など一定単位の中の原子の種類と数と配置を特定することと同義です。しかし、必ずしもそこまで詳しいレベルでの分析を意味しない場合も多くあります。
試料中の特定成分の量あるいは比率の決定を主眼とする分析を「定量分析」といい、試料中にある成分量を決定するために実施する化学分析です。試料中の成分が未知である場合は、定量分析に先立って定性分析を実施します。成分量を明らかにすることを「定量」といい、古典的には成分の重量を測定する「重量分析」、容量を測定する「容量分析」、化学変化による色調変化を比較測定する「比色分析」の3つの分析方法に分類されます。
重量分析と容量分析は物理的な物理量を直接測定し物質量を決定しますが、比色分析は予め、含量を精密に決定した基準試料を複数用意して化学変化の度合を未知試料と比較して間接的に決定します。
重量分析では、測定に先立って成分の分離を行い、その後質量を計測する必要があります。たとえば、試料中の塩化物イオンに硝酸銀を加えて塩化銀としてすべて沈澱させ、生成した塩化銀を濾過で分離捕集して乾燥重量を測定します。あるいは元素分析では炭素、水素、窒素量は重量分析で決定します。
容量分析は分離精製した気体の体積測定も含まれますが、通常は滴定法による滴下した容量を測定することを意味します。すなわち、滴下容量は試料中の成分の当量に比例するので、容量から当量を換算して成分量を決定します。
今日の機器分析では色調以外にも、電気、光学的強度、磁気、熱、放射能など多彩な物理量を測定することで定量分析が可能ですが、それらも比色分析同様に基準試料の応答と比較することで間接的に物質量を決定します。測定する物理変化量と物質量の間に、線形なグラフが成立する場合は検量線により、基準試料の空隙を補完することで精密に定量することが可能です。
今日では成分分離に高速液体クロマトグラフィー法を用い、量測定に各測定器を組み合わせた分析機器が定量分析用機器の主流になっています。
近代以前の化学と錬金術との差が明瞭でない時代には、外見や味の感覚的情報、密度や硬度、融点など物理的性質、酸やアルカリとの反応性、指示薬による比色分析または沈殿法による比濁分析など、経験的に蓄積された知識によって定性分析が行われていました。
18世紀に「近代化学の父」と称され質量保存の法則を発見したフランス人化学者アントワーヌ・ラヴォアジエ(1743~1794年)や気相の酸素の単離に成功して酸素の発見者とされるイギリス人自然哲学者ジョゼフ・プリーストリー(1733~1804年)らの研究によって、化学物質の本質的な構成要素である元素が徐々に発見されました。
19世紀前半に電磁気学や電気化学の分野での貢献で知られているイギリス人の化学者で物理学者のマイケル・ファラデー(1791~1867年)らによって電気分解の研究が進められ、多くの元素が単体として得られるようになり、元素の発見がさらに加速されました。
1704年にイギリス人自然哲学者アイザック・ニュートン(1642~1727年)が著書「光学」で光を分散・屈折・全反射・複屈折させるための光学素子である「プリズム」を最初に紹介しました。
1802年にイギリス人の化学者で物理学者のウイリアム・ウォラストン(1766~1828年)により、太陽光をプリズムに通して得られる分光スペクトルのなかに、太陽の元素により吸収されてできる暗線(フラウンホーファー線)のあることが報告され、18世紀から19世紀において、スペクトルを研究する分野として分光学が確立しました。19世紀後半、ウォラストンは、自らが改良したブンゼンバーナーを利用してセシウムやルビジウムを発見したドイツ人化学者ロベルト・ブンゼン(1811~1899年)とともに分光学研究に取り組み、太陽光スペクトルの暗線がナトリウムのスペクトルと同じ位置に見られることを明らかにしました。
分光学的方法により太陽の構成元素を同定できることを示したドイツ人物理学者グスタフ・キルヒホフ(1824~1887年)によって分光法が発展され、スペクトルから化学分析ができるようになりました。
19世紀後半から20世紀初頭にかけては、分析化学にとって重要な発見が続けられた時代でした。
1849年には、炭疽菌や結核菌、コレラ菌の発見者で、細菌培養法の基礎を開発したドイツ人の医師で細菌学者のロベルト・コッホ(1843~1910年)と共に、ワクチンの予防接種を開発し「近代細菌学の開祖」と呼ばれたフランス人の生化学者で細菌学者のルイ・パスツール(1822~1895年)が酒石酸の研究から、酒石酸の分子は非対称な形をしており、左手の手袋と右手の手袋のように、互いに鏡像の関係にある2種類の形が存在するという「キラリティー」の存在を光学分割により初めて実証しました。
19世紀には、いくつかのイオンの質量電荷比(質量mと電荷Zの比;m/Z)が電気化学的な方法によって測定されました。電子の質量電荷比は、1890年までにドイツ系イギリス人物理学者アーサー・シュスター(1851~1934年)によって測定され、さらに1897年にオランダ人物理学者ピーター・ゼーマン(1865~1943年)、ドイツ人地球物理学者エミール・ヴィーヘルト(1861~1928年)、イギリス人物理学者ジョセフ・ジョン・トムソン(1856~1940年)によって測定されました。この測定によって、電子が、実は電荷と質量をもった粒子であることが強く示唆され、その質量電荷比が、水素イオン[H+]よりもはるかに小さいものであることが示されました。
1886年、ドイツ人物理学者オイゲン・ゴルトシュタイン(1850~1930年)は、低圧力下でのガス放電において、陰極から陽極へ移動する負に荷電した陰極線とは逆方向である、陽極から穴のあいた陰極のチャネルを通って離れていく線を観察しました。ゴルトシュタインは、これらの正に荷電した陽極線を「カナル線」と呼びました。
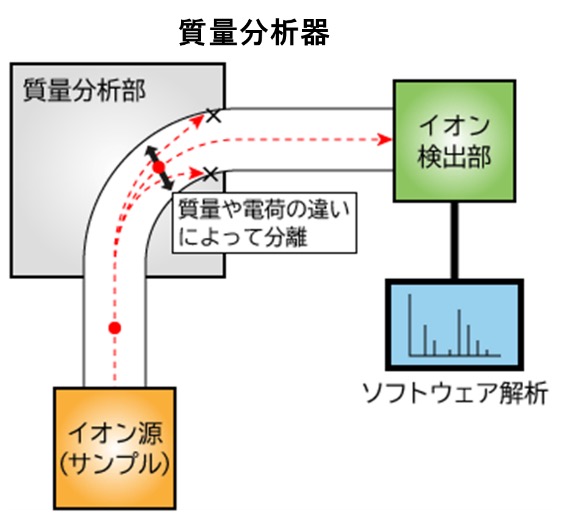
ドイツ人物理学者ヴィルヘルム・ヴィーン(1864~1928年)は、強力な電場あるいは磁場がカナル線を偏向させることを発見し、1899年に陽極線を質量電荷比に応じて分離させる平行電場および磁場を持つ装置を組み立て、分子に高電圧をかけ、真空中で試料をイオン化して静電力によって装置内を飛行させ、イオンを電気的・磁器的な作用等により質量電荷比に応じて分離し、それぞれのイオンを検出することでマススペクトルを得る「質量分析法の原理」を発見しました。その後、1913年にジョセフ・ジョン・トムソンは、ヴィーンの装置を改良し、圧力を減らすことで質量スペクトルグラフを作り出し、イオンの質量電荷比を、彼がパラボラスペクトログラフと呼んだ装置で測定しました。今日では、この質量電荷比を測定する装置を「質量分析器」と呼んでいます。
1906年にイタリア系ロシア人植物学者ミハイル・ツヴェット(1872~1919年)がクロロフィルの研究過程で「クロマトグラフィーの原理」を発見し、これらは分析化学へと応用されました。
1895年にドイツ人物理学者ヴィルヘルム・レントゲン(1845~1923年)がX線を発見しました。1912年にドイツ人物理学者マックス・フォン・ラウエ(1879~1960年)が硫化亜鉛結晶によるX線回折現象を発見し、続く1913年には、父親であるイギリス人物理学者ヘンリー・ブラッグ(1862~1942年)とその息子のイギリス人物理学者ローレンス・ブラッグ(1890~1971年)によってブラッグの法則が発表され「X線回折」による構造解析に理論的な基礎が確立されました。1916年にはオランダ人の物理学者で化学者のピーター・デバイ(1884~1966年)とスイス人物理学者パウル・シェラー(1890~1969年)が粉末試料から構造を解析する「デバイ-シュラー法」を発表し、X線回折による構造解析が広く行われるようになりました。
その後、オーストリア系イギリス人化学者マックス・ペルーツ(1914~2002年)による重原子同型置換法や分子の結晶構造の決定に新しい数学的方法を導入したユダヤ系アメリカ人数学者ハーバート・ハウプトマン(1917~2011年)による直接法などの開発、さらには放射光やコンピューターの進歩により、X線回折法は複雑な結晶にも適用が可能となりました。20世紀中頃には、X線回折法は構造生物学においても広く用いられるようになり、1953年のイギリス人の物理学者で結晶学者のロザリンド・フランクリンによるDNAのX線回折写真は、二重螺旋構造解明に重要な寄与をしたことが知られています。
1927年に磁場の電子線に対するレンズ作用を実験で示したのは、電子光学の創始者と呼ばれるドイツ人物理学者ハンス・ブシュ(1884~1973年)でした。
1925年、フランス人理論物理学者ルイ・ド・ブロイ(1892~1987年)によって電子の波動性が提唱されると、この考え方に基づいて1931年にドイツ人物理学者エルンスト・ルスカ(1906~1988年)とドイツ人電気技術者マックス・クノール(1897~1969年)によって最初の電子顕微鏡である、観察対象に電子線をあて、透過してきた電子線の強弱から観察対象内の電子透過率の空間分布を観察する「透過型電子顕微鏡(TEM)」が発明されました。さらにルスカは性能を高め、この功績で1986年にノーベル物理学賞を受賞しました。ドイツの電気メーカーであるシーメンス社の科学ディレクターだったドイツ系アメリカ人電気技術者ラインホルト・ルーデンベルク(1883~1961年)が1931年に「透過型電子顕微鏡(TEM)」の特許を取得し、1938年に電子顕微鏡を売り出しました。
観察対象に電子線をあて、そこから反射してきた電子(または二次電子)から得られる像を観察する「走査型電子顕微鏡(SEM)」は、1937年にドイツ人物理学者マンフレート・フォン・アルデンヌ(1907~1997年)によって開発され、さらに加速電圧の向上などにより短波長の電子線によって性能は向上しています。電子顕微鏡の開発により、光学顕微鏡の限界を超えて分解能が格段に向上したことで、原子などを観察することが可能になり、極微構造の観察手法として欠かすことのできない機器として1950年代から多くの分野で活用されています。
1938年にはアメリカ人物理学者イジドール・イザーク・ラービ(1898~1988年)が「核磁気共鳴(NMR)」を発見しました。原子番号と質量数がともに偶数でない原子核は「0」でない核スピン量子数と磁気双極子モーメントを持ち、その原子は小さな磁石と見なすことができます。磁石に対して静磁場をかけると磁石は磁場ベクトルの周りを一定の周波数で歳差運動します。原子核も同様に磁気双極子モーメントが歳差運動を行います。この原子核の磁気双極子モーメントの歳差運動の周波数はラーモア周波数と呼ばれ、この原子核に対してラーモア周波数と同じ周波数で回転する回転磁場(電磁波)をかけると磁場と原子核の間に共鳴が起こります。この共鳴現象が核磁気共鳴と呼ばれます。ユダヤ系スイス人物理学者フェリックス・ブロッホ(1905~1983年)らによる改良を受けて、核磁気共鳴を用いて分子の構造や運動状態などの性質を調べる分析方法である「核磁気共鳴分光法(NMR)」が開発され、有機化学には欠かせない分析法へと発展していきました。
1982年には、アメリカのテクノロジー関連企業であるIBM社のドイツ人物理学者ゲルト・ビーニッヒ(1947年~生存)らによって、先端を尖らせた探針(プローブ)を用いて、物質の表面をなぞるように動かして微少な電流 (トンネル電流)を利用して表面状態を拡大観察する「走査型トンネル顕微鏡(STM)」が発明されました。これをもとに原子間力を利用する「原子間力顕微鏡(AFM)」をはじめとする多くの走査型プローブ顕微鏡が開発され、今日のナノテクノロジーの隆盛を支える重要技術となっています。
現在では、走査型プローブ顕微鏡は磁器ディスクの表面粗さ測定、DVDのスタンパーなど0.1μm前後の凹凸を測定する用途には不可欠な測定機器となっています。また、絶縁性の試料や水分を含んだ生体試料などの評価にも用いられています。
分析化学で得られた知見は、医療・食品・環境・ナノテクノロジーなど、社会的な幅広い分野で利用されています。
文献:
ウィキペディア・フリー百科事典
「分析化学」「定性分析」「定量分析」「アントワーヌ・ラヴォアジエ」「ジョゼフ・プリーストリー」
「マイケル・ファラデー」「アイザック・ニュートン」「ウイリアム・ウォラストン」「ロベルト・ブンゼン」
「グスタフ・キルヒホフ」「ロベルト・コッホ」「ルイ・パスツール」「キラリティー」
「ヴィルヘルム・レントゲン」「ヴィルヘルム・ヴィーン」「質量分析法」「ミハイル・ツヴェット」
「クロマトグラフィー」「ヘンリー・ブラッグ」「ローレンス・ブラッグ」「X線回折」「ルイ・ド・ブロイ」
「エルンスト・ルスカ」「マックス・クノール」「電子顕微鏡」「走査型電子顕微鏡」「透過型電子顕微鏡」
「イジドール・イザーク・ラービ」「核共鳴」「フェリックス・ブロッホ」「核磁気共鳴分光法」
「ゲルト・ビーニッヒ」「走査型トンネル顕微鏡」「原子間力顕微鏡」「走査型プローブ顕微鏡」
2024年12月5日
「化学の泉」投稿文(その35)/豆知識(はじまりシリーズ)
【タバコの歴史】
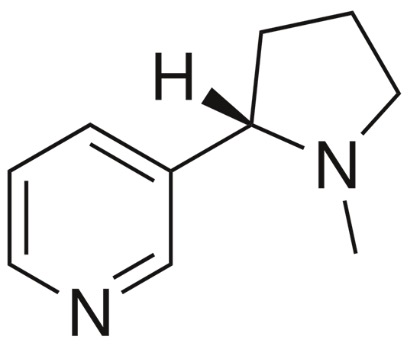
アルカロイドは、窒素原子を含み、ほとんどの場合塩基性を示す天然由来の有機化合物の総称です。多くのアルカロイドは他の生物に対して有毒で娯楽のための麻薬としての使用が知られていますが、しばしば薬理作用を示し医薬としても用いられています。また幻覚儀式において使用されています。よく知られるアルカロイドには、ニコチン、カフェイン、コカイン、モルヒネなどがあります。
ニコチンは、主にタバコの葉に含まれています。揮発性の無色の油状液体で、生体に対し強い依存性が有ります。現在、ニコチン依存症によるタバコの喫煙者だけでなく、その副流煙の受動喫煙者の健康に対しても公衆衛生上の大きな問題となっています。
ニコチンは、昆虫に食べられることを抑制するために、タバコ植物が作り出す毒物です。ナス・トマト・ジャガイモなど、ナス科の植物でもしばしば見られる物質ですが、タバコ以外の種ではその含有量は極少量です。
タバコの乾燥葉には、ニコチンが1~6%程度含まれています。ニコチンはアルカロイドの一種で猛烈な神経毒性を持っています。ニコチンは、骨格筋および脳に存在するニコチン性アセチルコリン受容体の受容体分子に働いて神経伝達物質やホルモンなどと同様の機能を示す「アゴニスト」として振る舞い、主に脳内の受容体に対して結合し、神経伝達物質である運動調節、ホルモン調節、快の感情、意欲、学習などに関わる「ドーパミン」、ストレス反応の中心的役割を果たし危機回避するための闘争や逃走反応において重要な役割を果たす「アドレナリン」、空腹、スリル、疼痛、母性、性行動、欲望が満たされた時に得られる快の感覚である報酬系と関係している「βエンドルフィン」の放出が促進されます。
ニコチンは、ニコチン性アセチルコリン受容体を介して、その薬理作用により毛細血管を収縮し、血圧を上昇させ、縮瞳(しゅくどう)、悪心、嘔吐、下痢、などを引き起こします。また、頭痛、心臓障害、不眠などの中毒症状、過量投与では嘔吐、意識障害、けいれんを起こします。
ニコチンの急性致死量は、イヌにおける半致死量からヒトにおける致死量は成人でタバコ20~40本程度の500~1000mgと推定されています。特に乳児や幼児のタバコの誤食によるニコチン中毒事故が多いので注意が必要です。従来、小児の致死量はタバコ1本(約25mg)とされてきましたが、誤食した小児の80%が無症状で死亡例がないために、現在では医療処置が胃洗浄から経過観察へと対応が変わってきました。

タバコはナス科タバコ属の南アメリカの熱帯原産の植物です。栽培種としては一年草として扱われていますが、原産地ではもともと多年草です。
タバコの種子の形状は回転楕円体で、重量は約50μgです。タバコの種子は光を感知するため発芽には太陽光が必要で、発芽温度は25℃です。成長すると茎は直立して草丈はおよそ2mになります。茎は繊維質で、薪などの代わりとして炊事などに利用されてきましたが、電気やガスの普及に伴い利用価値は無くなっており、そのまま次期の肥料として畑に廃棄されます。
葉は約30cmの大きさの楕円形です。葉は30枚から40枚が着生し、このうち、葉タバコとして採取するのは約60%です。これは葉の位置によってニコチンの含有量が異なるためです。日本国内では葉を5種類に区別し、上から上葉・本葉・合葉・中葉・下葉と呼びます。上葉は6%程度、下葉は1%程度のニコチンを含んでいます。葉の長さは20cmから60cm、幅は10cmから30cm程度で、葉の表面には液を分泌する細胞があり、特有の臭気を帯びています。また、葉には腺毛が多数あり、天然に豊富に存在するウラン239(238U)から始まる崩壊系列であるウラン系列の中に存在する核種で、空気中のポロニウムの放射性同位体、ポロニウム210(210Po)を吸着することが知られています。
花は夏期に柄のある小花が長い円錐形または円柱形に並び、付け根から先へ、あるいは周りから中心部へ咲いてゆく総状花序(そうじょうかじょ)で茎の先端部分に付き、花冠の形状は漏斗(ろうと)に似ており先端が5つに裂けています。色は種類によって異なりますが、栽培種では基部が白く、先端は淡い紅色のものが多く、果実1つ当り3000粒程度の種子を含みます。
人類がタバコをいつ頃から吸い始めたかはわかっていませんが、火を使い始めて様々な植物を燃やしたときに、なかには煙を吸うと心地よい香りの「香煙」を出す植物の存在を知ったのでしょう。
香を焚いて得る香煙は、人間に清新な活力や気力をもたらすばかりでなく、神の精霊が宿ると信じられ、これは世界各国に共通して見られる現象です。香を焚くことは、宗教的行事として重要な儀礼であるとともに、幻想的精神作用を起こすことから呪術にも必要とされ、さらに病気治療にも使われてきました。つまり、タバコを吸う前に、香煙を吸うことが行われていたと考えられています。
タバコは、紀元前から南アメリカ、中央アメリカの南部、西インド諸島、北アメリカのミシシッピ川流域で栽培されていました。多くの文献が取り上げているのが遺跡にある石彫りの絵文字です。
マヤ文明に代表されるメソアメリカ文明は、紀元前3000年頃から16世紀頃まで、メキシコ南東部、グアテマラ、ベリーズなど、いわゆるマヤ地域を中心として中央アメリカの地に栄えた文明です。その絵文字は、神がチューブ状のものを口にくわえ、先端から煙を吹かしている姿を表現しています。当時の人々がタバコを用いていて、そのことを神もお気に召していると考えたのでしょう。
マヤ文明では太陽神が崇拝されていました。「太陽=火の玉」という連想から、火や煙が神聖視されたのでしょう。タバコは香煙を出し、それを吸うといい気持ちになることから、タバコの煙に火の神の霊が存在していると信じられて、大切にされてきました。
1492年、大航海時代のイタリア人探検家で航海者のクリストファー・コロンブス(1451~1506年)一行は新世界における最初の上陸地サン・サルバドル島で、島の住民に与えたガラス玉、鏡などの贈り物の返礼として、新鮮な野菜とともに強い芳香のある葉を受け取りました。この葉こそタバコの葉で、島の住民はこの葉を「タバコ」と呼んでいました。彼らは、タバコを神聖な儀式に用いただけでなく、多くの病気の治療に用いていました。外傷、咳、歯痛、梅毒、リウマチ、寄生虫、発熱、しゃっくり、ぜんそく、しもやけ、扁桃炎、胃病、頭痛、鼻かぜなどの薬としていました。
タバコはスペインに伝えられ、以後ポルトガル、フランス、イギリスに広がり、人々を魅了し、喫煙の風習は急速な勢いで広まりました。
1559年、ポルトガルのリスボン駐在のフランス大使ジャン・ニコー(1530~1604年)が、フランス王国のフランソワ2世(1544~1560年)と母后カトリーヌ・ド・メディチ(1519~1589年)に医薬用目的としてタバコの乾燥葉を献上しました。カトリーヌはこれを頭痛薬用の粉タバコにして愛用しました。そのため当初、タバコは「王妃の薬草」と呼ばれていましたが、後にフランスにタバコを移入したジャン・ニコーを記念してニコティアーヌ(ニコチン)と呼ばれるようになりました。これがニコチンの名前の由来です。
16世紀になると喫煙の習慣は主に船乗りの間で一般的なものとなりました。1560年代にイングランドの海賊で海軍提督でもあったジョン・ホーキンス(1532~1595年)の船員によって喫煙の習慣はイングランドにもたらされましたが、1580年代に至るまで大きな影響を与えることはありませんでした。
イングランドでは1820年代後期から広く浸透し始め、1828年、スペインで紙巻きタバコ(シガレット)が登場し、一定の商業的な拡張をもたらしました。
イングランド女王エリザベス1世(1533~1603年)の後を受けて国王になったジェームズ1世(1566~1625年)はイギリス王を即位した翌年の1604年に、「タバコへの挑戦」と題する文章を出して、喫煙は野蛮人の悪しき風習であると非難しました。そして、タバコの輸入に約40倍の高関税を課し、タバコの販売を専売にして、イギリス国内のタバコの栽培を禁止しました。
ジェームズ1世の後を継いだチャールズ1世(1600~1649年)もタバコの専売を強化し、しばしば喫煙を取り締まりました。こうした国王のタバコの取り締まりに反対した議会や、議会を支援する国民との対立はエスカレートして、ついには、1642年から始まるイングランド・スコットランド・アイルランドで起きた内戦・革命であるピューリタン革命(1642~1649年)へと発展していきました。この革命の成功で喫煙は自由になり、一気に国民の間に広まりました。
世界史は高邁(こうまい)な理想によってのみ発展するものではなく、このように人間の「欲望」も背景にあることを覚えておきたいものです。
1665年、イギリスでペストが流行しましたが、その頃フランスから伝えられた嗅ぎタバコがペストの予防に効くとされて大流行しました。この頃、流行したコ-ヒ-とともにタバコはイギリス市民の社交上なくてはならないものになっていきました。
20世紀初頭に紙巻きタバコの安価な機械製造法が一般化されると、タバコの依存性により爆発的に喫煙人口が増加しました。第一次世界大戦(1914~1918年)の間、紙巻きタバコは典型的な軍事補給物資の一つでした。以降、紙巻きタバコを用いた喫煙は、魅力的で気楽な生活様式の一部としてタバコ会社により宣伝され、女性の喫煙も社会の中に浸透していきました。
日本にはポルトガルの宣教師がタバコを伝えたといわれています。一説には1543年、種子島に漂着したポルトガル船が鉄砲と一緒に伝えたものといわれています。
江戸幕府(1603~1867年)は、1609年喫煙禁止令を出し、いわゆる「キセル狩り」などを行いました。これは幕府の贅沢禁止政策と火炎防止のためでしたが、とうてい禁止することはできず、広く民衆の間に喫煙習慣が広まっていきました。
日本では、日清戦争(1894~1895年)後、政府は財源確保のため、葉タバコの専売を実施し、日露戦争(1904~1905年)の最中である1904年に完全な専売制に移行して今日に至っています。
タバコの煙に含まれる化学物質は約3000種類あり、そのうち有害物質は200~300種類で、特に有害なものがタール、ニコチン、一酸化炭素などです。
1900年、生命統計学者らが、喫煙と疾患の関連を最初に示唆したとされる肺ガンの増加を指摘しました。その後さまざまな研究が行われ、タバコやタバコ煙の成分が分析され始めました。やがて臨床的・病理学的・疫学的に、タバコの人体への影響の研究が進み、1930年には肺や循環器疾患の発症率や死亡率の上昇が指摘されました。その後もさまざまな国・研究機関でタバコの研究は増えていき、ドイツではナチス統治下(1938~1945年)で、またアメリカ合衆国では1938年ごろアメリカ人生物学者レイモンド・パール(1879~1940年)が、タバコは健康に悪影響を及ぼすと発表しました。
1950年代から1960年代の間に医学界や各国政府のコンセンサス「喫煙は、特に肺ガンや心臓血管疾患に関して健康を脅かす」が発表され、喫煙がいかに公衆衛生に害を及ぼすかを示すことによって喫煙率を減少させるキャンペーンが始まりました。
WHO(世界保健機構)は2008年時点で、「世界各国で喫煙による死の予防が不十分である」と表明し、「タバコにより世界全体で毎年540万人が死亡している」と報告しています。
2017年、アメリカ連邦裁判所は、タバコ会社大手であるアルトリア、R.Jレイノルズ、フィリップモリスUSAなどに対しタバコの健康への有害な影響について「平均で1日に1200人のアメリカ人が喫煙により死亡していること、殺人や自殺、交通事故による死、エイズや薬物乱用、アルコールが原因の死などを全部合算した数よりも多くの人が、喫煙により死亡していること」を告知広告するように命令を下しました。
タバコを常用すると生じる依存症は、ニコチンによりドーパミン中枢神経系の興奮を介する脱抑制です。
喫煙によって肺ガンに罹ったとされる人の割合は、日本人で喫煙者の約70%、アメリカやイギリスなどでは喫煙者の80~90%とされています。

日本でも現在では、受動喫煙による死者が年間15、000人と推定され、ガンや心筋梗塞、中耳炎や虫歯などの口腔の病気、不妊や流産などの原因になることが指摘されています。
タバコの害は50種類にも及ぶとされていて、内訳としては、ガン(肺ガン、喉頭ガンなど10種類)、循環器疾患(血管収縮、心筋梗塞、狭心症、脳卒中)、消化器系疾患(胃潰瘍、十二指腸潰瘍、食欲低下)、その他、虫歯、歯周病、妊娠合併症、ビタミンCの破壊、免疫機能の低下、善玉コレステロースの減少、運動機能の低下、知的能力の低下、寿命の短縮、タバコ代による経済的な損失などがあげられます。
タバコの喫煙者による副流煙の受動喫煙が社会全体の健康に対して公衆衛生上の大きな社会問題となっている今、ニコチン依存症によるタバコの喫煙者が、自身の健康だけでなく受動喫煙者の人体に及ぼす有害性を充分に認識して禁煙行動をとり、社会全体の喫煙人口が減少することが望まれています。
文献:
ウィキペディア・フリー百科事典
「タバコ」「アルカロイド」「ニコチン」「ニコチン性アセチルコリン受容体」「アゴニスト」「神経伝達物質」
「ドーパミン」「アドレナリン」「βエンドルフィン」「ポロニウム210」「総状花序」「香煙」「マヤ文明」
「クリストファー・コロンブス」「ジャン・ニコー」「フランソワ2世」「カトリーヌ・ド・メディチ」「喫煙」
「エリザベス1世」「ジェームズ1世」「チャールズ1世」「ピューリタン革命」
2024年11月3日
「化学の泉」投稿文(その34)/豆知識(はじまりシリーズ)
【覚醒剤の歴史】
覚醒剤とは、薬用植物の麻黄(マオウ)に含まれるアルカロイドの成分を利用して精製した医薬品であり、アンフェタミン類の精神刺激薬です。シャキッとさせる薬という意味で、「覚醒剤」という名前がつけられました。
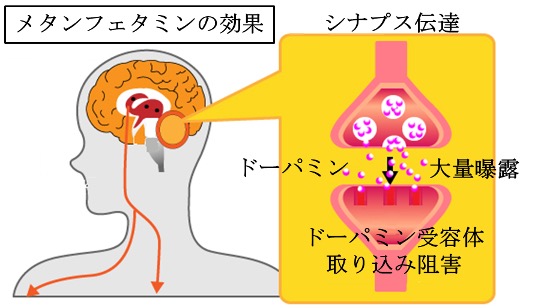
覚醒剤は、脳の中枢神経系に存在する、運動調節、ホルモン調節、快の感情、意欲、学習などに関わる神経伝達物質ドーパミン作動性に作用して心身の働きを一時的に活性化させます。乱用により依存を誘発することや、覚醒剤精神病と呼ばれる中毒症状を起こすことがあります。
日本では、覚醒剤取締法第二条で指定された薬物の総称で、濫用されているのはほとんどがメタンフェタミンで、自然界には存在せず、化学的に合成された物質です。
日本の覚醒剤取締法の定義では、広義には精神刺激薬を指し、狭義には覚醒剤取締法で規制されているうちメタンフェタミンだけを指すこともあります。俗に「シャブ」などと呼ばれ、医師の指導で使われる疾病治療薬として、ヒロポンの商品名で、住友ファーマ(株)社で販売されています。
日本の覚醒剤取締法で管理される薬物には、フェニルアミノプロパンすなわちアンフェタミン、フェニルメチルアミノプロパンすなわちメタンフェタミン、およびその塩類やそれらを含有するものがあります。反復的な使用によって薬物依存症となることがあります。法律上、覚醒剤取締法として他の麻薬と別扱いであり、所持、製造、摂取が厳しく規制されています。フェニル酢酸から合成する手法が一般的ですが、アミノ酸のフェニルアラニンを出発物質として合成することもできます。
アンフェタミン、メタンフェタミンは、血液脳関門を通り越して脳内報酬系としても知られていて、脳幹の背側の領域である腹側被蓋野(ふくそくひがいや)から大脳皮質と大脳の奥深くに存在する尾状核、被殻からなる大脳基底核の外側を取り巻くようにある辺縁系に投射するドーパミン作動性神経のシナプス前終末からのドーパミン放出を促進しながら再取り込みを阻害することで、特に側座核内神経付近にドーパミンの過剰な充溢を起こし、当該部位のドーパミン受容体に大量のドーパミンが曝露することで覚醒作用や快感の気分を生じさせます。
副作用としては、血圧上昇、散瞳など交感神経刺激症状が出現し、発汗が活発になり、喉が異常に渇き、内臓の働きは不活発になり多くは便秘状態となります。性的気分が容易に増幅され、反面、男性の場合は薬効が強く作用している間は勃起不全となります。常同行為が見られ、不自然な筋肉の緊張、キョロキョロと落ち着きのない動作を示すことが多く、さらに、主に過剰摂取によって死亡することもあります。食欲は低下し、過覚醒により不眠となりますが、これらは往々にして使用目的にもなっています。
日本の薬学の父と呼ばれた東京帝国大学薬学および化学教授 長井 長義(1845~1929年)は、13年間のドイツ留学から帰国し、1884年に衛生局東京試験所長となり,漢方薬の成分の化学的研究に着手しました。同試験所の技師 山科 元忠(生年不詳~1885年)が、ぜんそくや咳の漢方薬「麻黄」のエーテル抽出できわめて少量の結晶を得たので、さらに多くの材料をつくらせ1種のアルカロイドを発見するに至りました。その後、山科が病没したために、同試験所の技師 堀 有造(生没年不詳)の協力を得て、この遺業を継ぎ、麻黄のアルカロイドを取り出す研究を開始し、2年後にその結晶を「エフェドリン」と命名しました。
長井は、東京帝国大学医科大学の医師 高橋 順太郎(1856~1920年)・三浦 謹之助(1864~1950年)に薬理学研究を委託し、1888年にはエフェドリンの瞳孔散大、血圧上昇作用が明らかとなり、エフェドリンおよび関連アルカロイドの構造が決定されました。
1887年にベルリン大学のルーマニア系ユダヤ人化学者ラザール・エデレアヌ(1861~1941年)が、エフェドリンからアンフェタミンを合成し、1893年に長井と医師で東京帝国大学医科大学教授 三浦 謹之助によってエフェドリンからメタンフェタミンが合成されました。1919年、長井の弟子である薬学者 緒方 章(1887~1978年)が、メタンフェタミンの結晶化に成功しました。

覚醒剤としての使用は、アメリカ人薬理学者で化学者のゴードン・アレス(1901~1963年)が、1933年にアンフェタミンから吸入式喘息薬を開発し、アメリカの製薬会社スミス・クライン・アンド・フレンチ社から「ベンゼドリン」として市販され、咳止めというより疲労回復のために長距離トラック運転手や、スーパーマンになれる薬として学生の間で乱用され、また食欲減退効果があることから、ダイエット薬として販売する業者も現れました。こうした乱用の報告を受けてFDA(アメリカ食品医薬品局)が、1959年に処方制限に踏み切りました。
ナチス統治下のドイツでは1938年、アンフェタミンより数倍の強力な効果があるメタンフェタミンが、「ペルビチン錠」として市販されました。
日本では1941年、大日本製薬(株)(現在の住友ファーマ)がメタンフェタミン製剤を「ヒロポン」として、武田薬品工業(株)社がアンフェタミン製剤を「ゼドリン」として、各々市販しました。
ヒロポンの効果については、医学界で発売以降に様々な研究がなされ、「服用すれば心気を爽快にし、疲労を防ぎ、睡魔をはらう等の興奮効果があり、しかも習慣性、蓄積作用等がない」として、除倦(じょけん)覚醒効果が強く有用な薬品で常習性はないと分析されました。ヒロポンの言語は俗に「疲労をポンと飛ばす」といわれていますが、実際はギリシア語“フィロポヌス(労働を愛する)”が正しい語源です。
その効果は、強烈な快感、多幸感や高揚した気分を味わえ、3時間から12時間程度にわたって覚醒状態が持続し、そのあいだは眠ることも物を食べることもしなくなります。ただし、本当は体が食事や休息を欲しているのに、ドラッグの力で錯覚しているだけなので、効果が切れた後は激しい抑うつ、疲労、倦怠感、焦燥感に襲われます。
一般に麻薬や覚醒剤と呼ばれる薬物は歴史の全編を通じて人類に影のように寄り添っています。近代になると国家権力が人々の生活の隅々にまで入り込み、それに伴って国家と薬物の関係が築かれてきました。
国家権力と覚醒剤が結びついた例は日本にもありました。アヘン戦争(1840~1842年)は「アヘンに苦しむ人民を救おう」として清朝政府が起こした事件でしたが、日本で起きたことはかなり違います。それは、「日本政府が国民に覚醒剤を与えた」というものであり、政府の方針としては反対の立場です。
しかし、断っておかなければならないのは、これは日本に限った話ではないという点です。第二次世界大戦(1939~1945年)では日本の同盟国であるドイツやイタリアでも同様なことが行われました。また、第二次世界大戦後20年ほど後のベトナム戦争当時(1960~1975年)にも、米軍で行われたようです。
それは戦地(死地)に赴く戦士に、その恐怖を除き、士気を高め、「戦闘能力を高める」ために覚醒剤を与えて送り出した、というものです。
日本軍での覚醒剤の使用目的は、当時の医学界の研究成果の通り、「疲労回復」や「眠気解消」や「士気向上」程度を期待されていたものと推察されます。
仕事の能率を高めるなどとして精神科医の方面から宣伝され、夜戦の兵士や、軍需工場の工員に能率向上として半強制的に用いられ、兵役中に味を占める者も出てきました。
「パイロットの塩」などと呼ばれるほど、塩なみのパイロットの必需品として使用していたドイツ空軍にならって、日本軍においてもナチス・ドイツの情報を元にして生産された「ヒロポン入りチョコレート」が、戦闘機パイロットに対して、疲労回復の目的で支給されていました。また「大空のサムライ」と呼ばれ、太平洋戦争(1941~1945年)におけるエース・パイロットであった海軍中尉 坂井 三郎(1916~2000年)もラバウルで連日激しい空中戦を戦っていた際に、疲労回復のブドウ糖と一緒にヒロポンを注射されたと戦後に軍医に明かされたことを証言しています。
前途ある若者が覚醒剤を与えられ、正常な判断力を麻痺させられ、体当たり的な特別攻撃を行う“特攻隊員”として命を無駄に散らさせられたと考えると、耐えられないものがあります。これが後に日本における覚醒剤の代名詞になった「ヒロポン(メタンフェタミン)」でした。
薬学の専門家からは、メタンフェタミン自体が鎮咳剤エフェドリンの誘導体として開発された経緯もあり、初めは咳止め効果を期待していましたが、覚醒効果の方が顕著だったために、主に眠気解消剤として夜間作業に関わる兵士用に応用されていたという指摘もありました。

第二次世界大戦で敗戦を迎えた日本の秩序は崩壊し、経済は疲弊し、混乱の中にありました。多くの人々は脱力と虚無の境地をさまよいましたが、そのようななかでも勤勉な日本人は懸命に働き、懸命に勉強しようとしました。このような社会にアダバナのように狂い咲いたのがヒロポンでした。当時、ヒロポンに現在の覚醒剤のような悪いイメージは無かったといいますが、その正体は覚醒剤であることは明らかです。仕事に熱中する労働者、受験勉強に熱中する受験生、あらゆる分野の「頑張る屋さん」がヒロポンを用いました。
覚醒剤の悲惨さは、精神的依存性のすさまじさにありました。効果が切れると一転して不安と狼狽に襲われるために、再びハイな気分を求めて運用することになり、幻覚や妄想など精神病症状が出現します。また、攻撃的、暴力的傾向になりやすく、依存性が強く、長期の後遺症を残しやすくなります。
覚醒剤濫用者の死因としては、急性中毒死が多く、心臓血管系の障害が推定されるほか、事故による外傷死、自殺などが多いようです。
覚醒剤をやめてから5年、10年という月日が過ぎてからでも、突然幻覚や幻聴が現れたりするフラッシュバックが起こります。この依存症やフラッシュバックを消し去る薬はいまのところありません。
日本で覚醒剤のリスクが認識されたのは1947年に入ってからでした。気づいたときには、すでに遅く、1954年には、経験者200万人、使用者50万人から100万人、中毒者20万人とされ、多くの犠牲者が出ました。
1950年に薬事法で劇薬に指定され、さらに翌年1951年に覚醒剤取締法が施行されましたが、時すでに遅く、すでに密造の覚醒剤が流通し、極めて深刻に蔓延していました。取締りは逆に暴力団に流通を握らせることとなりました。
覚醒剤自体は非常に安価に製造できますが、取引が非合法化されているため闇ルートでの流通となり、末端価格は数百倍にも跳ね上がりました。
1980年代後半以降は芸能人・ミュージシャンなどの知名度や影響力の高い人物が覚醒剤使用で検挙されるケースが後を絶たず、繰り返しセンセーショナルな社会的話題となっています。
そして1995年から検挙数が増加し第三次乱用期とされ、携帯電話が普及し、元締めは暴力団ですが末端の販売員がイラン人や一般人となり暴力団関係者と接触することなく入手できるようになりました。また、同年にはオウム真理教が「修行」として覚醒剤を密造し信者に投与していたことが発覚し問題となりました。
現在、日本の覚醒剤はほとんどすべて国外で製造され密輸入されたものです。北朝鮮・台湾・トルコなど各地からの密輸が相当量あるといわれ、特に北朝鮮の覚醒剤は同国の主要な外貨獲得手段となっていると指摘されています。
メタンフェミンは、水に溶けやすい白色、無臭の結晶です。そのため、従来は静脈注射を用いましたが、最近は、注射器を用いる暗いイメージがなくなり、手軽で注射痕が残らないことから、加熱吸引法や錠剤、液剤の乱用が流行しています。中学生・高校生が栄養剤感覚や痩せ薬感覚で手を出したり、主婦がセックスドラッグと騙されて服用したりするケースも増加し、薬物汚染として社会問題になっています。
文献:
ウィキペディア・フリー百科事典
「覚醒剤」「麻黄」「アンフェタミン」「ドーパミン」「覚醒剤取締法」「メタンフェタミン」「腹側被蓋野」
「長井 長義」「山科 元忠」「ラザール・エデレアヌ」「エフェドリン」「高橋 順太郎」「三浦 謹之助」
「緒方 章」「坂井 三郎」「Gordon Alles」「ヒロポン」
2024年10月1日
「化学の泉」投稿文(その33)/豆知識(はじまりシリーズ)
【麻薬(コカ、大麻、シビレタケ)の歴史】
アルカロイドは、窒素原子を含み、ほとんどの場合塩基性を示す天然由来の有機化合物の総称です。多くのアルカロイドは他の生物に対して有毒で、しばしば薬理作用を示し、医薬や娯楽のための麻薬としてや、幻覚儀式において使用されています。よく知られるアルカロイドには、ニコチン、カフェイン、コカイン、モルヒネなどがあります。
植物から抽出した天然由来のアルカロイドに手を加えたものが、イネ科植物およびカヤツリグサ科植物の穂に寄生する麦角菌(ばっかくきん)の麦角アルカロイドから誘導された半合成の幻覚剤LSD(リゼルグ酸ジエチルアミド)やアヘンに含まれるモルヒネから誘導されたヘロイン、麻黄(まおう)に含まれるエフェドリンから誘導された覚醒剤のヒロポン(メタンフェタミン)です。天然由来のアルカロイドの分子構造を参考に人工的に化学合成されたものが、エフェドリンから合成された覚醒剤のアンフェタミンです。
ほとんどの幻覚性植物の成分は、コカイン、モルヒネのようにアルカロイドですが、大麻では有効成分はアルカロイドではなく、幸福感を覚えるなどの作用がある向精神薬カンナビノイドの一種のテトラヒドロカンナビノールです。
歴史上に現れる麻薬は、天然の植物から採るものであり、ケシ、コカ、大麻、キノコ類のシビレタケが知られています。麻薬の王様と呼ばれる「ケシ」については、前回の第32回投稿文でふれたので、残りの「コカ」「大麻」「シビレタケ」の歴史を見てみましょう。
(1)コカの木の葉のアルカロイド

コカインは、無色無臭の柱状結晶です。南アメリカなどが原産の「コカの木の葉」に含まれるアルカロイドで、局所麻酔薬として用いられ、また精神刺激薬にも分類されています。
コカイン原料のコカの木は、主にコロンビアやボリビアなど、南米の人里離れた山岳地帯の畑で密かに栽培され、現地農民によって手作業で葉をむしって袋詰めされます。コカの葉は密林の中に隠された作業場に集められ、細かく破砕され、溶媒となる石油類に浸して撹拌し、麻薬成分を溶出させます。これに希硫酸を混ぜた後、アルカリで中和し、上澄みを捨て、沈殿物を集めて乾燥させ、「コカ・ペースト」が製造されます。
コカ・ペーストは、原産地で製造される粗製抽出物です。石油や硫酸などの溶媒に汚染された非合法のコカ・ペーストは、往々にして毒性を持っています。現地農民から買い取られたコカ・ペーストを酸で処理し、過マンガン酸カリウムで不純物を取り除き、濾過してコカイン濃度を高め、精製したものがコカインです。
「クラック」は、アメリカ合衆国でよく使用される形態で白い塊になっており、これはコカイン塩酸塩を重曹と混ぜたもので、気化しやすく吸入摂取で用いられています。
南アメリカのペルー、ボリビア、(チチカカ湖周辺)、エクアドルを中心にケチュア族が築いたインカ帝国(13世紀頃~1533年)では、コカの木の葉を国民に毎日、一定の時刻に使用することを許していたと言われています。国民の生活が苦しく、空腹による飢餓感を抑えるためと強壮剤として用いられていたようです。
1855年にドイツ人化学者フリードリヒ・ゲードケ(1828~1890年)が初めてコカの葉からコカインアルカロイドを単離し、1859年、「有機化学の父」と呼ばれたドイツ人化学者フリードリヒ・ヴェ-ラー(1800~1882年)門下で毒ガス兵器であるマスタードガスの発明者であるドイツ人化学者アルベルト・ニーマン(1834~1861年)が単離法を改良し、翌1860年に詳細な性質を報告して「コカイン」と命名しました。
発売当初、コカインはモルヒネ中毒の治療薬として宣伝されていました。1880年代のイギリスでは一般人でも容易に入手可能であり、ロンドンではコカインとモルヒネと注射器がセットになったギフトボックスが販売されていました。コカインの性質が充分に理解されていなかった頃には、依存性がないと考えられたために、他の薬物依存症の患者に対し、コカインを処方することで治療できると考えられていました。
1884年まで眼科手術は、わずかな刺激に反応する目の不随意反射運動のため、行うことが困難でしたが、オーストリア人眼科医カール・コラー(1857~1944年)が、コカインの局所麻酔薬としての可能性を医学界に示し、眼科手術のための局所麻酔薬としてコカインを導入しました。コラーはコカインによる局所麻酔による手術に成功したことで有名になり「コカ・コラー」というニックネームで呼ばれました。その後、コカインを使った局所麻酔は歯科や外科などに普及しました。
1880年代、アメリカ合衆国の南北戦争(1861~1865年)に南部連合国軍人として参加して重症を負っていたアメリカ人薬剤師ジョン・ペンバートン(1831~1888年)は、長年モルヒネを服用しモルヒネ中毒に陥るとモルヒネに代わって痛みを和らげ、そのうえ依存性がないものを探し、コカ、ワイン、アフリカの熱帯雨林に植生するアオイ科コラノキ属のコーラの実から抽出したカフェインを含むほろ苦い味のコーラ・エキス、芳香植物の葉であるダミアナなどを混ぜた「フレンチ・ワイン・コカ」を発明しました。発明した翌年1885年、禁酒法によってアルコールが制限されると材料からワインを取り除いて「コカ・コーラ」と命名し薬局で売り出しました。コカ・コーラは、FDA(アメリカ食品医薬品局)が存在しなかった当時は鬱(うつ)やヒステリー、消化不良や心身の疲れ、モルヒネやアヘンへの依存、精力増強や頭痛に効く万能薬であると宣伝して販売されました。 コカ・コーラには20世紀初頭までコカインの成分を含み、薬局などで売られ、誰でもコカイン入り飲料を飲むことができました。しかし、アメリカ南部の新聞で「黒人のコカイン中毒者が白人女性を強姦したが警察はそれを止めることができなかった」と報じられたことにより、コカインの有害性が明らかになると、1903年にコカ・コーラ社はコカインの使用を中止し、代わりに大量の砂糖とカフェインが用いられるようになりました。
しかし、規制後もコカインは裏社会で流通し続け、アメリカでは、ベトナム戦争時にアメリカ軍兵士が日常的にコカインを摂取しており、ベトナム帰還兵が、アメリカ国内にそれを持ち込み、深刻な社会問題になりました。
1970~1980年代にかけて、コロンビアの複合犯罪組織メデジン・カルテルの台頭が全世界のコカイン市場の大半を牛耳るようになると、コカインの供給量が増え、その路上販売価格が下がると、コカインの摂取は貧しい人々や若者にも広がるようになり、深刻な社会問題として表面化しました。危機感を抱いたアメリカ合衆国は、これを壊滅させるべくNSA(国家安全保障局)やCIA(中央情報局)による諜報活動のうえ、アメリカ軍を派兵し、その拠点の空爆やミサイル攻撃、銃撃戦を繰り広げ、2000年代までに大型麻薬組織を撲滅しましたが、麻薬組織は細分化して、現在も存在し続けています。
コカインは、現在も有効な局所麻酔薬として手術に用いられています。しかし、服用すると幸福感や楽天感、性欲亢進などをおぼえるため、麻薬として、アメリカをはじめ世界中で濫用されています。
コカインは、「身体的依存性は無く、中断による禁断症状は起きない」とされていますが、精神的依存性は甚だしく、乱用から生じる中毒で死を招くことも多く見られます。アメリカではコカインの使用者が激増しており、その取り締まりは困難を極め、「麻薬戦争」といわれるほどの大きな社会問題になっています。
(2)大麻の葉や花の向精神薬カンナビノイド

大麻はアサ科アサ属の植物で、麻袋や麻布の麻(アサ)の原料植物と同じです。そのため、亜麻(あま;リネンの原料)などと区別するために大麻を「マリファナ」とも呼びます。大麻の繊維はとても丈夫で、衣服や袋・バッグなどに用いられます。
大麻は麻酔性のTHC(テトラヒドロカンナビノール)と呼ばれる化学成分を含み、紀元前から幻覚剤として快楽、宗教、また医療などに利用されていました。
大麻の葉や花を乾燥させたものを細かく刻んでタバコのように使われることが多く、また大麻の樹脂(やに)や芽をすりつぶし、固めたものは大麻樹脂(ハシシ、チャラスなど)と呼ばれ、加熱して気化したものを吸引したり、タバコに混ぜて喫煙したりされています。
THCは脳の記憶や空間学習能力に関わる海馬や知覚と運動機能を司る小脳などに作用します。服用者によって個人差があり、用量や喫煙か経口摂取かなど投与経路によっても異なりますが、意識がだんだん変化して夢幻状態になります。そのために、思考の前後の関連性がなくなり、自由奔放に思考が駆け巡るようになり、数分が数時間に感じられたり、近くのものが遠くにあるように見えたりします。大量に服用すると、幻覚を経験し、極端な安寧感や喜びの興奮が起こり、笑いが止まらなくなったりします。「精神的依存はそれほど強くなく、身体的依存もない」とされていますが、大麻を常用すると脳の機能低下、認知障害、呼吸器障害、生殖機能障害などの悪影響を及ぼします。
大麻の薬や嗜好品としての歴史は長く、シャーマンが薬理作用を目的としたとされる2700年前の大麻が、中国で発掘されています。2500年前の、かつて中国(東トルキスタン)に存在したオアシス都市国家の車師(しゃし)の墓地からも、麻の布がなく花穂の特徴から摂取を目的としたと考えられる大麻草13本が出土しています。
宗教面では、紀元前1200~紀元前800年に、医薬や儀式、シヴァ神への奉納物として使用されたと、バラモン教の聖典「ヴェーダ」に記されています。紀元前600年のゾロアスター教の経典「アヴェスター」では麻酔薬・鎮静剤として言及されています。
後漢(25~220年)の頃に成立したとされる中国最古の薬物学書「神農本草経」に、大麻が薬草として使われていたことが記されています。「歴史の父」と呼ばれる古代ギリシアの歴史家ヘロドトス(紀元前484~紀元前425年)は、歴史書「歴史」において、紀元前450年のスキタイ人やトラキア人は大麻を吸っていたと伝えています。70年にはローマ帝国の医学治療として大麻の使用が言及されています。アラビアと中東では900年から1100年にかけて大麻の喫煙習慣が広まりました。アメリカ大陸においては、1549年にアフリカ南西部にあるアンゴラから連れてこられた奴隷が、ブラジル東北部でのプランテーションで、サトウキビとともに大麻を栽培し、喫煙していました。アメリカ大陸のスペイン領やイギリス領でも大麻の栽培は行われ、特にメキシコでは大麻使用が大衆化していました。
ヨーロッパでは、嗜好品としての大麻は1798年のフランス革命期の軍人ナポレオン・ボナパルト(1769~1821年)によるエジプト遠征(1798~1801年)によってエジプトから伝えられ、1843年にはパリで「ハシッシュ吸飲者倶楽部」が設立されました。1870年にギリシアで大麻使用が全土に普及し、イギリスの上流階級や王室の間にも広がり、ヴィクトリア女王(1819~1901年)は生理痛の緩和に使用し、薬用としては腹痛や発熱、不眠症や結核患者に使われました。
1912年のハーグ阿片条約は、アヘンやコカイン、およびこれらから誘導された薬品が引き起こす害毒を禁止する目的で締結されましたが、大麻に関しては統計的・科学的見地から研究されることが望ましいとして、禁止されませんでした。
アメリカ合衆国では、1840年に医薬調合品として大麻の利用が可能になり、1842年から1890年代まで処方される薬の上位にありました。しかし、1915年~1927年には南西部州を中心に医療目的以外の大麻使用が州法で非合法化され始め、禁酒法の廃止や治安悪化、人種差別や移民問題、大麻の繊維に代わる合成繊維の普及による大麻栽培の減少と相まって、1937年に連邦法によって非合法化されました。1960年代には旧来の価値観に対抗するカウンターカルチャー の一翼を担った若者による「ヒッピー・ムーブメント」で大麻使用が大衆化され、ベトナム戦争の戦場で、大麻を吸うアメリカ軍兵士が急増しました。アメリカにおける1980年代までの取り締まりは、アメリカでの摘発を免れるための屋内栽培を増加させ、生産技術の向上を招き、その技術は世界中に広まりました。医療大麻については、連邦法との板挟み状態にあり、医療目的で大麻を使用する患者、薬局などが逮捕や強制捜査を受けるなどのグレーゾーンでしたが、2009年に医療大麻に対する取り締まりが終結されました。
現在、国際的には非合法の国のほうが圧倒的に多く、何らかの形で医療大麻を合法化しており、規制緩和が進むものの、イギリス、ドイツ、フランスなどでは依然として大麻は違法薬物であり、日本を含むほとんどの国で娯楽用としての大麻吸食は法律で厳しく禁止されています。
(3)シビレタケ属のキノコ類のアルカロイド

かつて中央アメリカの地に栄えたマヤ文明で代表されるメソアメリカ文明(紀元前3000年頃~16世紀頃)では、神々を祭る手段として人間を神への生贄とする人身御供(ひとみごくう)が広く行われていました。とくに穀物の神シペ・トテックなど、幾柱かの神に対する儀式の際は、石器のナイフを用いて生贄の全身の皮を剥がし取り、剥がされた皮を神官が身にまとって踊るなどの儀式を行っていました。悪魔の植物「テオナナカトル(神の肉)」と「ペヨーテ」の服用により、生贄は幸福そうに、陶然として死んでいきました。
「ペヨーテ」はサボテンの一種で、アルカロイドなどの陶酔性成分メスカリンを含んでおり、服用すると鮮やかな色彩幻覚を生ずる一方、強い吐き気などの中毒作用もおこします。
「テオナナカトル」はシビレタケ属の毒キノコで、アルカロイドのシロシビンやシロシンという幻覚を引き起こす成分を含んでいます。このトリプタミン系アルカロイドのシロシビンやシロシンを含んだ菌類のキノコは200以上存在し、世界中に広く自生しています。
1957年に、アメリカ人のアマチュア民族菌類学者ロバート・ゴードン・ワッソン(1898~1986年)によるメキシコ実地調査の記録がアメリカの雑誌「ライフ」で「悪魔のキノコを求めて」として掲載され、このキノコの存在が公になりました。フランス国立自然史博物館館長で菌類を専門とするフランス人植物学者ロジェ・エイム(1900~1979年)はワッソンに同行して、この地方を探検し、ワッソンと共に強い催幻覚性作用を有するキノコの研究を行い、麦角アルカロイドから幻覚剤LSDを合成したスイス人化学者アルバート・ホフマン(1906~2008年)が研究員として在籍するスイスの製薬会社サンド社に催幻覚性作用を引き起こす物質の特定を依頼しました。ホフマンは、幻覚性のあるキノコからシロシビンとシロシンを発見し化学構造を特定しました。
一時期、これらのキノコ類の乾燥品は、「マジックマッシュルーム」という名前で、インターネット上で販売されていました。現在では麻薬原料物質としてシロシビンやシロシンを含むキノコ類が規制の対象になっており、輸入、輸出、栽培、譲り受け、譲り渡し、所持、施用、広告といった行為は法律で規制されています。日本では2002年から、シロシビンを含有するキノコ類を故意に使用・所持することは麻薬及び向精神薬取締法によって規制されています。
麻薬は、生体のさまざまな生理活動を調節したり、影響を与えたり、活性化したりする生理活性を持つものが多く、医薬品として重要ですが、「薬」と「毒」は表裏一体なので、薬にも毒にもなり、その使用に当たり充分に考慮する必要があります。
文献:
ウィキペディア・フリー百科事典
「アルカロイド」「麦角菌」「LSD」「アヘン」「モルヒネ」「ヘロイン」「麻黄」「大麻」「コカイン」
「コカ・ペースト」「クラック」「フリードリヒ・ゲードケ」「フリードリヒ・ヴェ-ラー」
「Aldert Hofmann」「Karl Koller」「南北戦争」「ジョン・ペンバートン」「コーラ」「コカ・コーラ」
「メデジン・カルテル」「大麻」「海馬」「小脳」「テトラヒドロカンナビノール」「車師」「バラモン」
「ゾロアスター教」「神農本草経」「ヘロドトス」「ナポレオン・ボナパルト」「ハーグ阿片条約」
「ヴィクトリア(イギリス女王)」「ヒッピー・ムーブメント」「マジックマッシュルーム」「ペヨーテ」
「テオナナカトル」「サイロシビン」「サイロシン」「ロバート・ゴードン・ワッソン」「ロジェ・エイム」
「アルバート・ホフマン」
2024年9月3日
「化学の泉」投稿文(その32)/豆知識(はじまりシリーズ)
【麻薬(ケシ)の歴史】
アルカロイドは、窒素原子を含み、ほとんどの場合塩基性を示す天然由来の有機化合物の総称です。多くのアルカロイドは他の生物に対して有毒で、しばしば薬理作用を示し、医薬や娯楽のための麻薬としてや、幻覚儀式において使用されています。よく知られるアルカロイドには、ニコチン、カフェイン、コカイン、モルヒネなどがあります。
麻薬は、昏迷・昏睡、痛みに対する無感覚を誘発する化学物質で、通常はケシの果実に天然に生成される、数種類の麻薬性鎮痛薬のオピオイド・アルカロイドを指します。
歴史上に現れる麻薬は、天然の植物から採るものであり、ケシ、コカ、大麻の三種類の植物が知られています。その中でも、ケシからはアヘン、モルヒネ、ヘロイン、オピオイド、などが作られ、麻薬界の王様と呼ばれています。

【①アヘン】
アヘンにはアヘンアルカロイドと総称される様々な化合物が含まれていますが、その代表的なものの一つが「モルヒネ」です。アヘンはモルヒネを大量に含み、代表的な麻薬です。
ケシの原産地はヨーロッパや北アフリカとされています。紀元前3500年頃、古代メソポタミア南部地域(現在のイラク南部地方)に住んでいたシュメール人はケシを「喜びの花」と呼んでいたとも言われています。ケシの歴史はきわめて古く、紀元前1500年代の古代エジプトで医学について書かれた「エーベルス・パピルス」に、幼児がひどく泣くときはケシのシロップを与えるとよいと記されていました。
ケシは秋に種をまき、開花期は4~6月頃になります。花は茎の先端に一つだけ付き、つぼみのときは下向きで開花と同時に天頂を向きます。花が枯れて数日すると、芥子坊主(けしぼうず)と呼ばれる独特の形の握りこぶし大の果実を実らします。未熟果実に縦に傷をつけると白い乳液がにじみ出てほどなく茶褐色になります。これをヘラでかき集め乾燥させた粉末が生アヘンです。果実が熟すと植物体は枯死し、熟した果実の天頂に穴があき、微細な種子が飛び出します。苗が大きくなり、開花し、果実が成長するまでは高温・高湿度の雨季が必要で、その後は乾季が必要なために、バルカン半島、小アジア、イラン、インドなどで栽培され、イスラム商人の代表的な商品の一つでした。
ローマ帝国第5代皇帝ネロ時代(37~68年)の医師ペダニウス・ディオスコリデス(40~90年)は、アヘンの採取法及び薬効を著書の中で詳しく述べています。この時代には、アヘンはすでに鎮痛剤、睡眠剤として利用されていました。一部で遊興的な使用も行われましたが、多くは薬用でした。古代ヨーロッパにおけるアヘンの使用は、西ローマ帝国の滅亡(476年)により、一時廃ることとなりました。
5世紀前後、イスラム圏の交易網が発達し、インドや中国、アフリカの中部などの各地にアヘンはもたらされました。アラブ商人は医薬品としてのアヘンを商品とみなしていました。
11世紀前後、イスラム圏との接触を経て、アヘンはヨーロッパに再伝来しました。再び、医薬品として用いられました。15世紀頃からは麻酔薬としても用いられ、20世紀初頭までは民間療法の薬剤として用いられていました。
大航海時代(15世紀中期~17世紀中期)を経ての西欧諸国による海上貿易において、アヘンは重要な商品となりました。中国では、西欧諸国、特にイギリスによりアヘンがもたらされ、アヘン禍に陥りました。イギリスは交易において清国からイギリスへ「茶」、イギリスからインドへ「綿織物」、インドから清国へ「アヘン」と三角貿易の構造を構築し、アヘンを用いて資産を獲得しました。
清国では、上海など都市の河沿い地域に使用者が多く、当初は運搬船の停泊船内や宿場などで煙草に混ぜて吸入されていました。19世紀、このアヘンの蔓延に危機感をつのらせた清国がイギリス商人のアヘンを焼却したことが、イギリスと清国の間で、アヘン戦争(1840~1842年)の引き金となりました。しかし、この紛争後もアヘン流入量が縮小されず、市中では次第に半固形の阿片膏を煙管(キセル)に入れて吸入するようになり、この携行しやすい阿片膏によって、より清国内の広域へアヘンが浸透しました。
ヨーロッパにおいては、「アヘンの危険性の認知」や「アヘンの習慣を持つ者が多い中国人の各地への移住とそれによる中国人コミュニティーとの接触」に伴い19世紀には反アヘン運動が高まりました。また、アメリカ・カナダへの中国人労働者の流入ともに、特にサンフランシスコをはじめとする地域でアヘンが浸透し、1875年に至り反ドラッグ法制定など対策が行われました。
20世紀初頭から、国際間におけるアヘンの統制が始まり、1912年にはハーグ阿片条約が調印され、アヘン貿易が制限されました。1920年に国際連盟が成立してからは、連盟が統制に関する職務を負い、国際機関が設置されました。1926年の第一・第二阿片会議条約では、アヘンの使用等に関しても統制され、1928年の麻薬製造制限条約においてアヘン貿易は完全に禁止されました。国際連合に移行後も、同様の統制体制が持続し、現行の1961年の麻薬に関する単一条約においてもアヘンは統制されています。
アヘンは中枢神経を麻痺させることで、激しい痛みを抑えしずめます。また、激しい咳発作を抑え、下痢を止め、催眠や麻酔補助の目的で使用されます。効果はモルヒネと同様ですが、作用は穏やかで効き目が遅く、副作用として悪心、嘔吐、頭痛、めまい、便秘、皮膚病、排尿障害、呼吸抑制、昏睡などの慢性中毒を起こし、乱用すると廃人同様になります。また、アヘンは麻薬なので習慣性があり、慢性中毒を起こし多量に用いなければ効かなくなります。
【②モルヒネ】
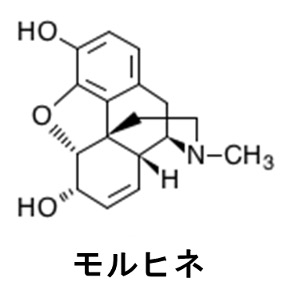
モルヒネは、脳内や脊髄に作用し、痛みを脳に伝える神経の活動を抑制し、鎮痛作用を示します。細胞内でのタンパク質合成に使われる22のアミノ酸のうちの一つチロシンから生合成されるオピオイド系の化合物で、アヘンはモルヒネを大量に含んでいます。1804年、ドイツ人薬剤師フリードリヒ・ゼルチュルナー(1783~1841年)によって、史上初めて薬用植物から分離されたアルカロイドです。
ゼルチュルナーは、この薬が「夢のように痛みを取り除いてくれる」ということから、ギリシア神話に登場する、ケシの花に囲まれて眠るという夢の神モルペウスにちなんでモルフィウムと名づけ、効用の研究・宣伝に当たりました。1805年には鎮静催眠薬として精神医学にも導入されました。1853年の皮下注射針の開発までは、モルヒネは普及しませんでしたが、その後鎮痛のために用いられ、また、アヘンやアルコールの依存症の治療薬として用いられました。
アメリカ合衆国の南北戦争(1861~1865年)ではモルヒネが負傷兵の鎮痛剤として広く使用され、軍人病(モルヒネ依存症)による40万人を超える被害者を生み出しました。
またナポレオン3世(1804~1873年)のフランス帝国とプロセイン王国間の普仏戦争(1870~1871年)においても、同様のことが西欧で起こりました。モルヒネの依存症を克服する目的で、モルヒネを原料とする「ヘロイン」が1898年に発売されました。
【③ヘロイン】
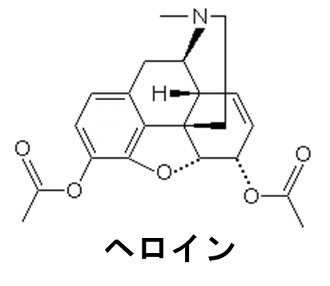
モルヒネと同様、ヘロインはケシから採ったアヘンに含まれているモルヒネを化学的に加工して作られます。ヘロインはモルヒネの持つ2つの水酸基を、共に酢酸とのエステルにした分子です。これを合成するためには、モルヒネを無水酢酸で数時間煮ます。
アスピリンを作ったことで有名なドイツの化学会社バイエルの前身に当たるエルバーツェルト色素製造工場・薬理研究所が、中枢神経を麻痺させる薬として開発し、1898年に発売しました。その効き目がずば抜けていたことから、ドイツ語の「ヘロイッシュ(英雄的)」という言葉より「ヘロイン」と名付けられました。ドイツの科学者は、気管支炎、慢性の咳や喘息、肺結核に効果があると結論づけ、モルヒネなどに代わる依存作用のない薬であると発表し、国際的に宣伝しました。そのために、どのような病気にも効く、副作用のない奇跡の薬のように言われ、医師と薬局から無制限に市場に流れることとなりました。ヘロインは、その後30年以上、ドイツでは自由に入手可能でした。
1912年のアヘンやモルヒネの誘導体を規制するハーグ阿片条約は、第一次世界大戦(1914~1918年)のため各国の条約の批准が延期されました。第一次世界大戦終了後にドイツでは、1921年に批准されると、ヘロインは麻薬に指定され回収されました。アメリカでも1924年に医薬品の指定が取り消されました。その年のアメリカの常用者は推定で20万人と見積もられていました。
国際規制の後に、常用が広がるにつれ密輸・闇市場が増大しました。ヘロインの製造はヨーロッパの工場ではなく、中国・上海の密造工場や、フランスのマルセイユのコルシカ人による犯罪シンジゲートへと移りました。これはかえって、1930年代に非合法のヘロインをあふれさせ失敗となりましたが、第二次世界大戦(1939~1945年)が始まると、国境警備の厳しさなどによって密輸が不可能となり、混合物によって純度も低下し、アメリカ合衆国では戦争終結までに常用者は2万人まで下落しました。
1949年に中国大陸で中国共産党が勝利し、腐れ縁のない中華人民共和国政府は商人を容赦なく処罰したために、ヘロインの供給地は東南アジア諸国へと移っていきました。
ベトナム戦争(1964~1975年)では、ラオス北東部で戦争を行っていたメオ族を支援するため、CIA(アメリカ中央情報局) が市場へのアヘン運搬を支援し、1965年から1971年までCIAの秘密の航空会社であったエア・アメリカが空輸しました。1965年に、ラオスのアヘン製造所は、純度90%以上の高純度ヘロインを精製するようになっており、結局これらは、ベトナム駐留米軍の兵士の手に渡りました。1968年に南ドイツで不法なヘロインが登場すると、ベトナム戦争で負傷した兵は治療のために、不運にも西ドイツに送られ、帰国したベトナム帰還兵は密売を思いつくようになりました。
アメリカで麻薬患者は白人社会に流行し、1969年末には推定31万5千人とされ、4年前の約5倍に膨れ上がり、1971年推定56万人となったため同年6月に大統領リチャード・ニクソン(1913~1994年)が、薬物に対する戦いを宣戦布告しました。
1990年代、黄金の三角地帯と呼ばれる東南アジアのタイ、ミャンマー、ラオスの3国がメコン川で接する山岳地帯や、アフガニスタン東部のジャラーラーバードから南部のカンダハールを経て南西部のザランジ南方へと続く黄金の三日月地帯で生産されるようになったアヘンから、ジャングルの中で、モルヒネの分離を経てヘロインが製造されるようになりました。
【④オピオイド】
ケシから採取されるアルカロイドや、そこから合成された化合物、また、体内に存在する内因性の化合物を「オピオイド」と総称し、医療においては手術や、がんの疼痛の管理のような強い痛みの管理に不可欠です。2000年以降のアメリカでは、ヘロインを乱用した者の75%による処方薬のオピオイドの乱用が始まり、処方されたオピオイドによる過剰摂取死は2009年までの10年間で4倍となりました。2010年以降になると、アヘンに含まれるアルカロイドのテバインから合成された「オキシコドン」が薬物過剰摂取死の最多原因となり、2017年には「オピオイド危機」と呼ばれる公衆衛生上の非常事態が宣言されました。OECD(経済協力開発機構)25カ国のオピオイド関連死亡の増加に対して、疼痛管理目的の処方や過剰処方の増加を挙げて、臨床ガイドラインや、処方サーベイランス強化などにより、処方規制の改善が勧告され、医療サービスへの大きな負担となっています。
アヘン戦争が日本に与えた衝撃は大きく、開国後も国内のアヘン乱用は許しませんでした。第一次世界大戦でイギリスをはじめとするヨーロッパ列強が中国から後退した隙に、1932年、日本は中国東北部に傀儡政権、満州国を樹立すると、日本の関東軍はイギリスに代わって内モンゴルを中心に莫大な量のアヘンを生産し、中国全土に流しました。日本が持ち込んだのは生アヘンを精製してつくられた鎮痛用の薬剤モルヒネやヘロイン、コカインで、満州国予算の20%以上をアヘン収入で支える、大きな資金源になりました。また、日本軍部の特殊工作資金も、アヘン利権を通じて生み出されたもので、1945年の敗戦まで、深く、広範囲に、アヘンに関係していました。
現在、日本は世界でも有数の麻薬消費国になりつつあり、潜在的な麻薬患者も急増しつつあります。ヘロインなどの麻薬・覚醒剤が暴力団を通して広く売られ、その常用者・中毒者は、青少年やOLから主婦にまで広がり、大きな社会問題になっています。
麻薬は、生体のさまざまな生理活動を調節したり、影響を与えたり、活性化したりする生理活性を持つものが多く、医薬品として重要ですが、「薬」と「毒」は表裏一体なので、薬にも毒にもなり、その使用に当たり充分に考慮する必要があります。
文献:
ウィキペディア・フリー百科事典
「麻薬」「アルカロイド」「アヘン」「モルヒネ」「皇帝ネロ」「ペダニウス・ディオスコリデス」
「西ローマ帝国」「大航海時代」「アヘン戦争」「ハーグ阿片条約」「麻薬製造制限条約」「ヘロイン」
「チロシン」「フリードリヒ・ゼルチュルナー」「南北戦争」「ナポレオン3世」「普仏戦争」
「バイエルン(企業)」「万国阿片条約」「ベトナム戦争」「リチャード・ニクソン」「黄金の三角地帯」
「黄金の三日月地帯」「オピオイド」「オキシコドン」
2024年8月3日
「化学の泉」投稿文(その31)/豆知識(はじまりシリーズ)
【核融合の歴史】
核融合反応とは、軽い核種同士が融合してより重い核種になる核反応を言います。単に核融合と呼ばれることも多く、核分裂反応と同じく20世紀初頭から研究されていました。核融合反応を連続的に発生させエネルギー源として利用する核融合炉も20世紀中旬から研究されており、フィクション作品にはよく登場しますが、現実には技術的な困難を伴うため2024年現在、まだ実用化はされていません。
古代ギリシアの唯物論的原子論から発展して、「原子」や「分子」の存在が認識され、18世紀後半以降の定量化学の発展で「原子の粒子性」が明らかになり、トリウム(Th)、ポロニウム(Po)、ラジウム(Rd)などの放射性元素の発見により、それ以上分割できない不生・不滅の粒子としてのアトム(原子)という旧来の知識を一新し、それまでの、「原子は決して壊れない物」という概念が否定されました。フランス人物理・化学者アンリ・ベクレル(1852~1908年)、ポーランド人物理・化学者マリー・キュリー(1867~1934年)、「原子物理学の父」と呼ばれるケンブリッジ大学のニュージランド人物理・化学者アーネスト・ラザフォード(1871~1937年)らの研究により、原子核はさまざまな形で放射性崩壊を起こし、他の元素に変化することが明らかにされました。
その後、1938年、ドイツ人物理・化学者オットー・ハーン(1879~1968年)、ドイツ人物理・化学者フリッツ・シュトラスマン(1902~1980年)、ユダヤ系オーストリア人化学者リーゼ・マイトナー(1878~1968年)とユダヤ系オーストリア人物理学者オットー・ロベルト・フリッシュ(1904~1979年)らは、ウランの核分裂を理論的に明らかにしました。
核分裂とは、ある原子核がそれより軽い複数の原子核に分割され、場合によってその他の粒子も発生する核反応もしくは放射性崩壊をいいます。この過程では多くの場合ガンマ線が発生し、放射性崩壊の基準で言っても莫大な量のエネルギーが生み出されます。当時の科学者はすでにアルファ崩壊やベータ崩壊について知っていましたが、核分裂のように原子番号が大きく変わる過程は想定外の発見でした。また核分裂は連鎖反応が可能であることから核兵器や原子力発電の発展につながっているため非常に重要な意味を持っています。
ウランの核分裂の際に中性子が放出される現象が発見されると、核分裂連鎖反応から多大なエネルギーを得る「原子爆弾(原爆)」が考えられました。
核融合の研究は、核分裂反応と同じく20世紀初頭に始まりました。1920年、イギリス人物理・化学者フランシス・アストン(1877~1945年)は、「4個の水素原子の総質量相当量が1個のヘリウム原子(ヘリウム4)の総質量より重く、水素原子を結合してヘリウムを形成することで正味のエネルギーが放出されることを暗示している」ことを発見し、恒星(太陽)がエネルギーを生み出すメカニズムの最初のヒントを与えました。
1920年代には、イギリス人天文学者アーサー・エディントン(1882~1944年)が、太陽を動かす主要なシステムとして陽子-陽子連鎖反応(PP連鎖反応)を提唱しました。陽子-陽子連鎖反応とは、恒星の内部で水素をヘリウムに変換する核融合反応の一種で、「熱核融合反応」と呼ばれる水素原子核の合計質量の0.7%が質量とエネルギーの等価性によって熱量に転換される反応です。
1932年に、イギリス人物理学者ジョン・コッククロフト(1897~1967年)らは、元素を人工的に別の元素に変換させた最初の実験である陽子の加速実験を始め、リチウムに加速した陽子を衝突させて、原子核の変換に成功しました。この粒子加速器の研究に従事していた物理学者たちは、陽子(水素原子核)や他の軽い核に高いエネルギー(数keV)を与え入射粒子として加速し、標的となっている軽い核に当てると、核の電気的反発力や核力によって入射粒子は破壊を伴いながら、標的と融合し大きなエネルギーが解放されること、すなわち核融合反応(nuclear fusion)を発見しました。
この大きなエネルギーは、ユダヤ系ドイツ人理論物理学者アルベルト・アインシュタイン(1879~1955年)によって主張された関係式「E=mc2」 を満たす形で、融合した核の質量の一部がエネルギーに変換されるため発生します。しかしながら、加速器による核融合反応では、少数の核融合物を作るために大量のエネルギーが必要であり、もし実用に供するような連続的な核融合反応を起こすのであれば数億℃もの高温が必要となることから、以後に発見された核分裂反応ほどには当初は着目されませんでした。
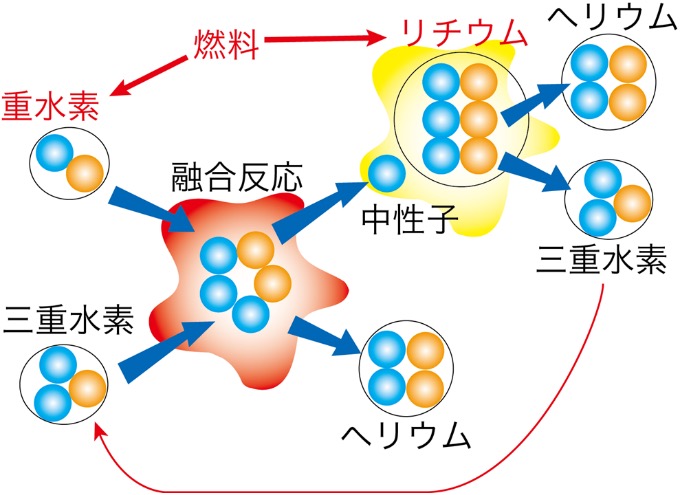
核融合により生成される中性子は,1933年にケンブリッジ大学のラザフォードの研究員によって初めて検出されました。この実験法はオーストラリア人物理学者マーク・オリファント(1901~2000年)によって開発され、最大60万電子ボルトのエネルギーで陽子を標的に向かって加速するというものでした。
核物理学のメッカとも呼ばれる、ケンブリッジ大学に所属するイギリスの物理学研究所であるキャベンディッシュ研究所は、共有結合を発見したアメリカ人物理・化学者ギルバート・ルイス(1875~1946年)から数滴の重水を受け取り、加速器を用いて様々な標的に向け発射し、オリファントはラザフォードらと協力して、ヘリウム3(ヘリオン)とトリチウム(トリトン)の核を発見しました。
1939年にユダヤ系アメリカ人物理学者ハンス・ベーテ(1906~2005年)によって検証された理論では、「太陽の核におけるベータ崩壊とトンネル効果が陽子の一つを中性子に変換し、それによってジプロトン(ヘリウム2)ではなく重水素が生成される可能性がある」ことが示されました。
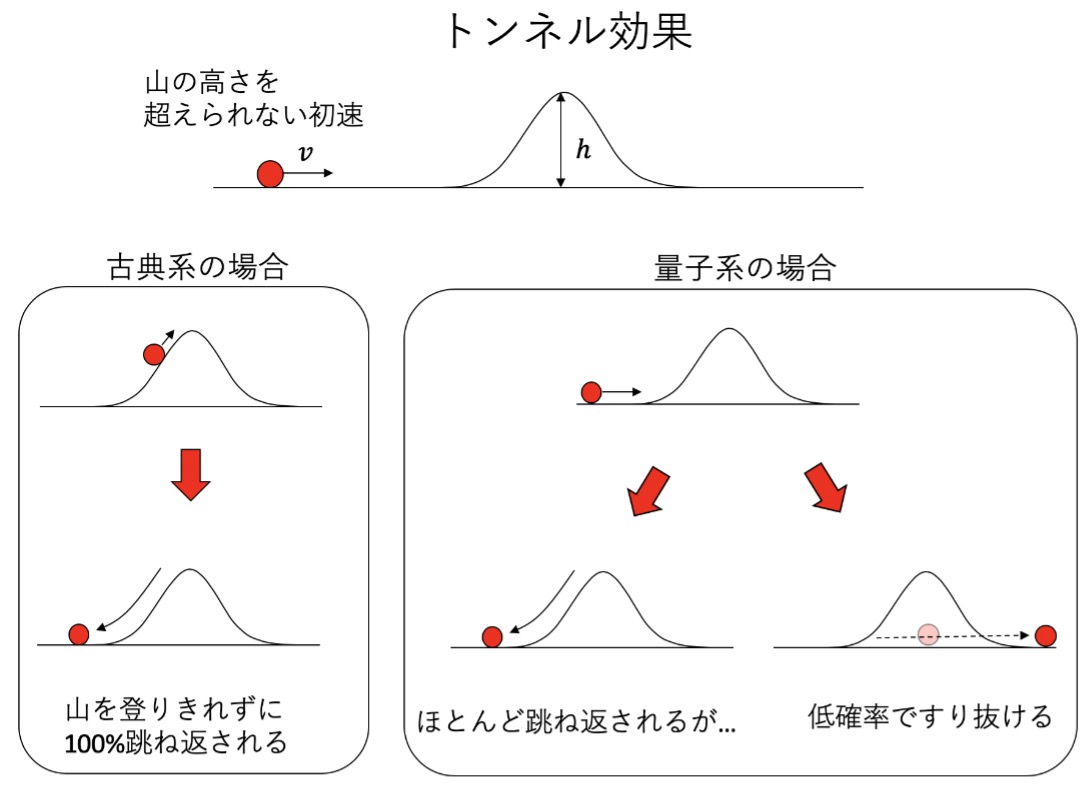
トンネル効果とは、 量子力学において、波動関数がポテンシャル障壁を超えて伝播する現象で、例えば、ポテンシャル障壁に向かっている粒子を、丘を転がり上がるボールに喩えて考えた時、古典力学においては、障壁を乗り越えるだけのエネルギーを粒子が持っていない限り、粒子は障壁の向う側には到達できません。つまり、丘を乗り越えるだけのエネルギーを持たないボールは、途中で止まり丘を転がり落ち戻っていきます。ところが、量子力学においては、ある確率で粒子は障壁を貫通します。この場合、「ボール」は環境からエネルギーを「借りて」丘を乗り越え、反射電子のエネルギーを高くすることによってそのエネルギーを返済します。太陽の核において、このトンネル効果のエネルギーが陽子の一つを中性子に変換し、それによって重水素が生成されます。重水素はその後、他の反応を経て融合し、エネルギー出力をさらに高めることになります。この研究により、ベーテはノーベル物理学賞を受賞しました。
核融合炉に関する最初の特許は、1946年に英国原子力庁により登録されました。発明者は、イギリス人物理学者ジョージ・パジェット・トムソン(1892~1975年)らで、プラズマを流れる電流が周囲に磁場を形成して自己収縮して自発的に高温高密度状態を作り出す物理現象である「Zピンチ概念」の最初の詳細な検討でした。1947年から2つの英国のチームがこの概念に基づいた小規模な実験を実施し、さらに大規模な実験を構築し始めました。
最初に成功した人工核融合装置は、1951年の核実験(グリーンハウス作戦)で試験されたブースト型核分裂兵器でした。これに続き、1952年のアイビー作戦で真の核融合兵器、1954年のブラボー実験で最初の実用兵器としての「水素爆弾(水爆)」が出現しました。
水爆は、原爆を起爆装置として用い、核分裂反応で発生する放射線と超高温、超高圧を利用して、水素の同位体の重水素や三重水素(トリチウム)の核融合反応を誘発し莫大なエネルギーを放出させます。高温による核融合反応(熱核反応)を起こすことから「熱核爆弾」や「熱核兵器」とも呼ばれ、核出力は原爆をはるかに上回ります。
通常の核分裂兵器は燃料を使い切る前に爆発しますが、核融合は中性子を放出し、これが周囲の核分裂燃料に当たることで、原子が通常の核分裂プロセスよりもはるかに速く、ほとんど瞬時に分裂します。
核融合反応による核出力の効率化は水爆1トンあたりTNT火薬換算6メガトンが理論上の限界であり、実際には起爆装置の原爆などの重量も含まれるため効率はさらに低下しますが、今のところ核融合・核分裂兵器である水爆の実用的な威力の上限に限界は存在しないと考えられています。
核爆発の際のエネルギー放出において中性子線の割合を高め、生物の殺傷能力を高めた「中性子爆弾」や、爆発プロセスが「起爆用原爆ウラン235の核分裂(fission)→水素同位元素の核融合(fusion)→高速中性子によるウラン238の核分裂(fission)」と3段階の核反応を経る「3F爆弾」も水爆の一形態です。
1945年、アメリカ軍は第二次世界大戦の終わりに、対ソビエト連邦を中心とする戦後の「世界戦略」を見据え、ソ連への自己の政治的優位性を示すために「すでに極度に疲弊して、降伏寸前の日本」に原爆投下を実施しました。広島市に世界初のウラン原爆「リトルボーイ」を投下し、続けて長崎市にプロトニウム原爆「ファットマン」を投下しました。その後、アメリカの原爆独占が続きましたが、1949年8月のソ連の原爆実験によってその独占は終了しました。
アメリカ合衆国大統領ハリー・S・トルーマン(1884~1972年)は、原爆保有国となったソ連に対してアメリカの優位性を維持するために、原爆と比較を絶する途方もない巨大なエネルギーが出る水爆の製造命令を下しました。初期の装置は核融合燃料として液体の重水素を用いていましたが、重水素を液体に保つには極低温状態を維持しなければならず、そのための装置が極めて巨大であるために、爆撃機やミサイルに搭載することは不可能で、実用化には至りませんでした。しかし、核融合燃料として常温で固体の重水素化リチウム(LiD)を用いることにより、実用化しました。

水爆は、実験を除けば、まだ本来の用途である大量破壊には使用されていません。
アメリカとソビエト連邦の冷戦のさなか、両国によって水爆の実験や開発が行われました。それでも米ソは朝鮮戦争、キューバ危機、ベルリンの壁をめぐる東西対立、ベトナム戦争においても核兵器を用いない「冷戦」を継続しました。
冷戦が終了して東西両陣営の対立がほぼ姿を消し、世界は核弾頭数を削減する道を歩きはじめましたが、現在は核弾頭数削減の停止、核兵器拡散と核テロの脅威など、「核の脅威」が再び持ち上がろうとしています。
第二次世界大戦後、科学者たちは、核兵器の廃棄と平和利用を直接世界の人々に訴える「ストックホルム・アピール」や「ラッセル=アインシュタイン宣言」などの行動に踏み出しました。
1957年には、世界各国の22名の科学者がカナダの漁村バグウォッシュに集まり、核兵器の危険性、放射線の危害、科学者の社会的責任について真剣な討議を行ったことをきっかけに、核廃絶をめざす国際平和会議「バグウォッシュ会議」が開催されました。発足以来毎年、世界各地で年次大会(現在は2年に1回)を開き、核兵器やその他の大量破壊兵器の廃絶や科学と社会の諸問題を取り上げています。
原爆を起爆剤に使用しない純粋水爆、いわゆる「きれいな水爆」の研究も進められています。これは起爆に原爆を使用しないため、核分裂反応による放射線降下物(フォールアウト)が生成されず、残留放射能が格段に減る仕組みですが、起爆時の核反応でアルファ線、ベータ線、ガンマ線および中性子線などの放射線、核融合やその燃え残りで生じた水素などの放射性同位体は少なからず放出されます。
2015年現在、米国でレーザーによる核融合が、またロシアでは磁場による核融合(Z-ピンチ方式)がそれぞれ研究されていますが、2016年時点ではこの種の兵器の開発は成功していません。
将来実現が期待される未来技術として、核融合反応に基づく熱エネルギーによって発電を行なう核融合炉があります。核融合炉は「地上の太陽」とも呼ばれ、きわめて希薄なエネルギー密度の太陽に比べて核融合炉のエネルギー密度は桁違いに高いために、実現は上手くいっても数十年先と言われていました。近年では、米国・英国を中心に核融合スタートアップが総額数千億円の投資を受けて実用化をめざしています。2022年12月には、米国ローレンス・リバモア国立研究所で、発生したエネルギーが投入量を上回る「純増」を初めて達成するなど、技術的にも画期的な進歩が続いています。
石油資源の枯渇や地球温暖化による異常気象を目の前にして、「地上の太陽」と呼ばれる、平和利用のための核融合炉発電の完成が待たれています。
しかし、現状は軍事利用において水爆の起爆に核分裂反応である原爆が使われたままです。平和利用のための核融合炉で使用するヘリウム3は、原子炉内でリチウム6に中性子を当てて三重水素を作り、これがベータ崩壊してヘリウム3を生産します。
現時点で、原爆も原子炉も、核融合反応を利用するためには必要不可欠なアイテムのままです。
文献:
ウィキペディア・フリー百科事典
「核融合反応」「フランシス・アストン」「アーサー・エディントン」「陽子-陽子連鎖反応」
「ジョン・コッククロフト」「アーネスト・ラザフォード」「マーク・オリファント」
「キャベンディッシュ研究所」「ギルバート・ルイス」「ハンス・ベーテ」「トンネル効果」
「ジョージ・パジェット・トムソン」「Zピンチ」「水素爆弾」「ハリー・S・トルーマン」
「重水素化リチウム」「ストックホルム・アピール」「」「バグウォッシュ会議」
「ラッセル=アインシュタイン宣言」
2024年7月1日
「化学の泉」投稿文(その30)/豆知識(はじまりシリーズ)
【核分裂の歴史】
古代ギリシアにおいて、哲学者デモクリトス(紀元前460年~紀元前370年)は、彼の師であるレウキッポス(生没年不詳)の原子論を継承し、「すべての物質は原子でできている」と主張しましたが、この原子は実体のない空想の産物でした。むしろ物質の性質に即していたのは哲学者エンペドクレス(紀元前490~430年)が提唱した四元素説で、「土、水、空気、火」すべて物質を思い浮かべられる定性的な考え方でした。原子も分子も微粒子ですが、これ以上分けられない微粒子として見ると分子は、さらに分割することができます。その結果出てきた微粒子である原子にはもはや物質の性質はありません。周期表に並んでいるのは原子ではなく、「元素」です。「原子と元素」の違いは、粒子という具体的な物質を指す場合は「原子」と呼び、概念を指す場合は「元素」と呼びます。
どのような化学的な方法によっても二種類以上の物質に分けることができないとき、その純粋な物質をつくっているものが「元素」です。たとえば水は、電気分解で水素と酸素に分けることができるため「元素」ではありません。水素や酸素は、それ以上別の物質にわけることができないので、それぞれが「元素」です。
このように元素は実験にもとづいて定義され、周期表の元素が追加されてきました。
18世紀後半以降の定量化学の発展によって「原子の粒子性」が明らかになり、19世紀末から20世紀にかけて、「原子は、もうそれ以上細かく分けることができない、物質の一番小さい単位である」という自然科学の常識がひっくり返るような物理学上の新発見が続きました。
まず、1895年にドイツ人物理学者ヴィルヘルム・コンラート・レントゲン(1845~1923年)が、X線を発見しました。これをきっかけに、1896年にフランス人物理・化学者アンリ・ベクレル(1852~1908年)が、ウラン(U)から放射線が出ていることを発見し、1898年にポーランド人物理・化学者マリー・キュリー(1867~1934年)らが、放射性元素トリウム(Th)、ポロニウム(Po)、ラジウム(Rd)を続けて発見しました。ポロニウム(Po)やラジウム(Rd)などの放射性元素の発見は、それ以上分割できない不生・不滅の粒子としてのアトム(原子)という旧来の知識を一新し、それまでの、「原子は決して壊れない物」という考えが否定されました。
1897年、イギリス人物理学者ジョゼフ・ジョン・トムソン(1856~1940年)が、真空放電の際にマイナス極から発生する「陰極線」の実験で、「電子」がすべての原子に共通して含まれていることを発見しました。
1898年に「核物理学の父」と呼ばれたケンブリッジ大学のニュージランド人物理・化学者アーネスト・ラザフォード(1871~1937年)は、トリウム(Th)が放射性の気体を放出すると述べ、気体の放射能を研究する中でベクレル放射線を二つに分け、それぞれ「アルファ放射線」、「ベータ放射線」と呼びました。続いてフランス人物理・化学者ポール・ヴィラール(1860~1934年)が第三のベクレル放射線を発見し、ラザフォードによって命名された手法にならって「ガンマ放射線」と呼びました。マリー・キュリーはラジウム(Rd)もまた放射性の気体を放出することに気づきましたが、その化学的同定には至りませんでした。ラザフォードとイギリス人化学者フレデリック・ソディ(1877~1956年)は、気体がアルゴンのように不活性であることを見出し、後にこの気体はラドン(Rn)として知られるようになりました。ラザフォードは「ベータ放射線」が陰極線(電子線)と同じものだと突き止め、さらに「アルファ粒子」がヘリウム原子核だという仮説を立て、この仮説は1909年にイギリス人物理学者トーマス・ロイズ(1884~1955年)によって証明されました。元素の放射性崩壊を詳細に観察したラザフォードとソディは、放射性生成物を特徴的な崩壊速度によって分類し、半減期の概念を導入しました。1903年にはソディとイギリス人医師マーガレット・トッド(1859~1918年)が、化学的・分光学的に同一だが放射性半減期の異なる原子に「同位体」と命名しました。同一元素の同位体は、電子状態が同じであるため化学的性質は同等です。しかし質量数は異なるため、結合、あるいは解離反応の速度などに微小な差が現れます。水素原子の同位体は、電子は1個、陽子は1個と共通していますが、中性子の数が異なります。そのために、質量が2倍差、3倍差となる水素原子の同位体では、軽水素と重水素、三重水素(トリチウム)のように顕著な物性の違いとなります。また、核スピンの値や、中性子吸収断面積など、原子核の性質は同位体核種ごとに異なります。そこで1959年、アメリカ人量子化学者ライナス・ボーリング(1901~1994年)が、同位体の存在を考慮し「元素とは、原子核の陽子数で分けた原子の種類のことである」と「一般化学」という教科書で定義した後に、化学者のあいだで公知となりました。
ラザフォードは、密度が高く正電荷を帯びた微小な原子核の周りを負電荷を帯びた電子が周回している原子模型を提唱しましたが、当時の電磁気学によれば、このような電子はエネルギーを放出して軌道半径を漸減して、原子核に埋没してしまうことになります。この問題に対して、1913年にデンマーク人理論物理学者ニールス・ボーア(1885~1962年)は、電子の量子的な性質を取り入れて改良した原子模型を提唱しました。このラザフォードの原子模型における矛盾を解消したボーアの原子模型が、原子構造の基礎的な考えとして現在も用いられています。
のちにアンリ・ベクレル、マリー・キュリーとその夫のフランス人物理学者ピエール・キュリー(1859~1906年)、ラザフォードらの研究により、原子核はさまざまな形で放射性崩壊を起こし、他の元素に変化することが明らかにされました。
1932年、ラザフォードの同僚であるアイルランド人物理学者アーネスト・ウォルトン(1903~1995年)とイギリス人物理学者ジョン・コッククロフト(1897~1967年)は、リチウム7(7Li)に加速した陽子を衝突させ、2つのアルファ粒子に分裂させるという、完全に人工的な核反応・核変換を達成しました。この実験結果は核分裂反応ではありませんが、「原子の分割」としてその偉業が知られ、「人工的に加速された原子粒子による原子核の変換」で1951年のノーベル物理学賞を受賞しました。
イギリス人物理学者ジェームズ・チャドウィック(1891~1974年)が1932年に中性子を発見した後、イタリア人物理学者エンリコ・フェルミ(1901~1954年)は、1934年にウランに中性子を照射して生じた物質について研究を行い、「中性子照射によって生成された、93個と94個の陽子を持つ新しい放射性元素の存在を証明したこと、および低速中性子によって引き起こされる核反応を発見したこと」により、1938年にノーベル物理学賞を受賞しました。
1938年、フェルミの分析結果に疑問を持った、ベルリンのカイザー・ヴィルヘルム化学研究所に所属していたドイツ人物理・化学者オットー・ハーン(1879~1968年)とドイツ人物理・化学者フリッツ・シュトラスマン(1902~1980年)は、同様の実験を始め、遅い中性子を照射されたウランから大幅に軽い元素であるバリウムが生成することを見出しました。ハーンはウラン原子核が複数の小さい原子核に分かれた可能性に気づきましたが、物理学的な根拠を見つけられませんでした。二人はこの発見を、元同僚で数か月前にナチス・ドイツを逃れてスウェーデンに移住していたユダヤ系オーストリア人化学者リーゼ・マイトナー(1878~1968年)に手紙で知らせました。マイトナーはハーンの共同研究者で、カイザー・ヴィルヘルム化学研究所の研究員を経てベルリン大学の教授となりましたが、ナチスのオーストリア併合によりユダヤ人の市民権が剝奪されたこともあり、スウェーデンに逃れていました。マイトナーは甥のユダヤ系オーストリア人物理学者オットー・ロベルト・フリッシュ(1904~1979年)とともにウラン原子核の分裂についての理論を立て、崩壊一つあたり放出されるエネルギーを約200メガ電子ボルトと計算しました。フリッシュは実験によってこれを証明し、結果は『ネイチャー』誌で発表されました。この過程はフリッシュによって生物の細胞分裂にたとえて「核分裂」と名付けられました。ハーンはこの発見により1944年のノーベル化学賞を単独で受賞しました。亡命まで共同で研究にあたっていたマイトナーが賞から漏れたことについては複雑な政治的、学問的事情が関わっていました。
核分裂とは、ある原子核がそれより軽い複数の原子核に分割され、場合によってその他の粒子も発生するような核反応もしくは放射性崩壊をいいます。この過程では多くの場合ガンマ放射線が発生し、放射性崩壊の基準で言っても莫大な量のエネルギーが生み出されます。当時の科学者はすでにアルファ崩壊やベータ崩壊について知っていましたが、核分裂のように原子番号が大きく変わる過程は想定外の発見でした。また核分裂は連鎖反応が可能であることから、原子力発電や核兵器の発展につながったため非常に重要な意味を持っていました。
ウランの核分裂の際に中性子が放出される現象が発見されると、核分裂連鎖反応から多大なエネルギーを得る「原子爆弾」が考えられました。現在の地球上に天然に存在している元素のうち、大量に存在しているものとしてはウランが最も原子番号が大きく、また最も原子量が大きい元素でもあります。天然に存在するウランには3つの主要な同位体があります。ウラン238(天然存在比99.28%)、ウラン235(天然存在比0.71%)、ウラン234(天然存在比0.0054%)です。
ウラン235の原子核に中性子をぶつけると、2つの新しい原子核に分裂し、原子爆弾(ウラン235を90%以上含む)や核燃料(ウラン235を3~5%含む)に用いられています。
ウラン235の1個に核分裂を起こさせると、中性子が2~3個飛び出し、同時に多くのエネルギーが放出されます。その時飛び出した中性子が、さらに近くにあるウラン235にぶつかり核分裂を起こします。これで飛び出した中性子が、また近くにあるウラン235にぶつかります。このように核分裂連鎖反応が起こり、その結果、きわめて多量なエネルギーが放出されます。
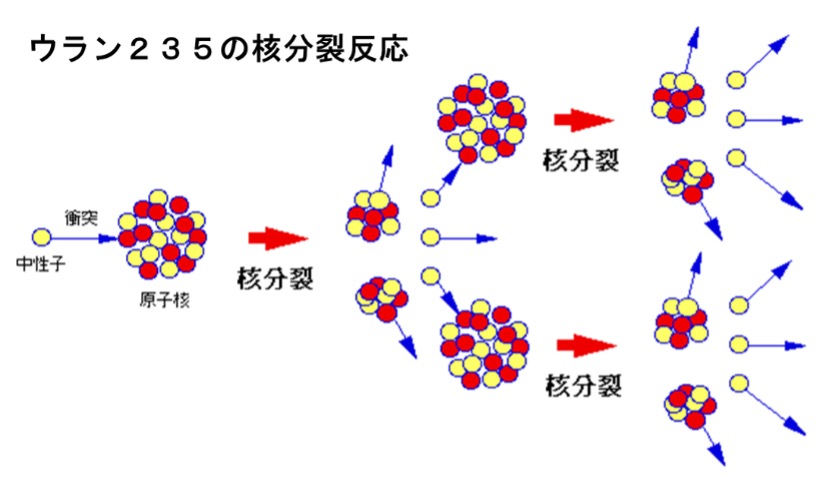
原爆は、核分裂性のウラン235やプルトニウム239をある一定量「臨界量」以上集合させれば爆発します。臨界量以下ならば決して爆発しません。自然状態での臨界量はウラン235で49キログラム、プルトニウム239で12.5キログラムです。しかし、反射材を使って核分裂物質に核分裂によって生じた中性子を反射してぶつけることで、臨界量をずっと少なくすることができます。反射材は中性子を反射する物質で、原爆の外側に逃げてしまう中性子を反射させて有効に使う目的で、ベリリウムが使用されています。プルトニウム核弾頭などで3~5キログラム前後に臨界量を減量できると推定されています。
強い放射線を持つプルトニウムは、1940年末にアメリカ人物理・化学者グレン・シーボーグ(1912~1999年)らによって人工元素としてはじめてつくられました。ウラン235に中性子を吸収させると、プルトニウム239をつくることができます。
「マンハッタン計画」は、第二次世界大戦中に行われたアメリカの原子爆弾製造計画の暗号名です。原子爆弾の開発・製造のために、科学者や技術者が総動員されました。1945年のはじめ頃までには、原子爆弾に使えるだけの量のプルトニウム239と濃縮度が高いウラン235を生産し、さらにさまざまな問題を解決して、7月には原子爆弾第一号が完成し、ニューメキシコの砂漠で爆発実験が行われました。原子爆弾が爆発すると1000万℃、数百万気圧の火の球ができ、初期放射線をごく短い時間放出し、徐々に温度が低下すると赤外線や紫外線を放射してあらゆるものを焼き尽くしました。さらには衝撃波が発生し、あらゆるものをなぎ倒し、強い放射線を持った死の灰をまき散らしながら、電磁パルスと呼ばれる強力な電磁波を発生させました。
1945年8月6日、アメリカ軍は広島市に世界初のウラン原子爆弾「リトルボーイ」を投下しました。爆心から2キロメートル以内がほぼ全壊・全焼し、同年末までに14万人が死亡したとされています。同月9日には、長崎市にプルトニウム原子爆弾「ファットマン」を投下して、約1万3000戸が全壊・全焼し、同年末までの死者は7万4000人と推定されています。
アメリカでは、「国家機密」を解かれた第二次世界大戦の際の日本への原子爆弾投下についての文書が公開されています。それによると、原子爆弾投下を決定したアメリカの指導者たちが見ていたのは、「すでに極度に疲弊して、降伏寸前の日本」ではなく、対ソビエト連邦を中心とする戦後の「世界戦略」を見据え、ソ連への自己の政治的優位性を示すために原子爆弾投下を実施したもので、「原爆が何千ものアメリカ人の命を救った」という話はいかがわしいようです。その後、アメリカによる原子爆弾独占が続きましたが、1949年8月のソ連の原子爆弾実験によってその独占は終了しました。

原子力発電は、原子炉内の核分裂反応の熱エネルギーを利用して、高圧の水蒸気を作り、蒸気タービンおよびこれと同軸接続された発電機を回転させて発電することです。
世界初の人工原子炉は、1942年12月に研究用原子炉シカゴ・パイル1号が臨界に達したことで稼動を開始しました。その後プルトニウム生産のため試験炉や生産炉が各地に建設され、1945年のはじめ頃までには、原子爆弾に使えるだけの量のプルトニウム239と濃縮度が高いウラン235が生産されました。
1953年12月に、時のアメリカ合衆国大統領ドワイト・D・アイゼンハワー(1890~1969年)が国連総会で行った原子力平和利用に関する提案「Atoms for Peace」が起点となり、核兵器だけに使用されてきた核の力を、原子力発電という平和利用に向けるという大きな政策転換が開始されました。アメリカではこの政策転換を受け、1954年に原子力エネルギー法が修正され、アメリカ原子力委員会が原子力開発の推進と規制の両方をすすめました。1954年6月、ソビエト連邦のモスクワ郊外オブニンスクにあるオブニンスク原子力発電所が、実用としては世界初の原子力発電所として発電を開始しました。
次に実用化されたのは潜水艦の動力炉で、原爆の開発からわずか9年後の1954年に最初の原子力潜水艦が進水しました。結局、軍事用に開発された原子炉を民間に転用するところから原子力発電は始まりました。いつの世も、軍事用技術開発が優先されるようです。
文献:
ウィキペディア・フリー百科事典
「核分裂反応」「放射能」「ジョゼフ・ジョン・トムソン」「ヴィルヘルム・コンラート・レントゲン」
「アンリ・ベクレル」「マリー・キュリー」「ピエール・キュリー」「アーネスト・ラザフォード」
「ポール・ヴィラール」「フレデリック・ソディ」「Thomas Royds」「Margaret Georgina Todd」
「ライナス・ボーリング」「ニールス・ボーア」「アーネスト・ウォルトン」「ジョン・コッククロフト」
「ジェームズ・チャドウィック」「エンリコ・フェルミ」「オットー・ハーン」「フリッツ・シュトラスマン」
「リーゼ・マイトナー」「オットー・ロベルト・フリッシュ」「原子爆弾」「グレン・シーボーグ」
「原子力発電」「ドワイト・D・アイゼンハワー」
2024年6月1日
「化学の泉」投稿文(その29)/豆知識(はじまりシリーズ)
【量子化学の歴史】
量子化学とは理論化学(物理化学)の一分野で、量子力学の諸原理を化学の諸問題に適用し、原子と電子の振る舞いから分子構造や物性あるいは反応性を理論的に説明づける学問分野です。また量子化学は、原子・分子といったミクロな粒子を取り扱う学問であり、そのような粒子を取り扱うことができる学問として量子力学が誕生したために、量子化学の発展の歴史は、量子力学の発展の歴史と切り離して述べることはできません。
古代ギリシアの唯物論的原子論から発展して、「原子」や「分子」の存在が認識され、定量化学の発展で「原子の粒子性」が明らかになり、放射性元素の発見によって「原子が他の原子に変化する」ことを明らかにして、「万物のもと」ともいえる「原子の構造」の足掛かりを得ることができました。さらに、「電子、原子、分子」のような極小物質の「粒子と波動の二重性」が明らかになり、波動に係わる物理量の振動を空間座標と時間の関数とした「波動関数」で原子に属する電子の挙動を表し、電子のエネルギーや軌道、さらに分子の軌道から化学結合の仕組みや結合エネルギーまで明らかにしてきました。
古代ギリシアの哲学者デモクリトス(紀元前460年頃~紀元前370年頃)は、彼の師であるレウキッポス(生没年不詳)の原子論を継承し、「古代原子論」を完成しました。「物質」である原子と、「真空」に相当する空虚の考えは現代の物質観に通じるものがありました。万物を「原子が支配する法則」であると考えた唯物論的原子論は、道徳論と結びつきやすい観念論とは一線を画すものであり、その後の西洋科学思考の根幹を流れました。
18世紀後期以降、1774年に「質量保存の法則」を提唱したフランス人化学者アントワーヌ・ラヴォアジエ(1743~1794年)が、1799年に「定比例の法則」を提唱したフランス人化学者ジョゼフ・ルイ・プルースト(1754~1826年)が、1802年に「倍数比例の法則」を提唱したイギリス人物理・化学者ジョン・ドルトン(1766~1844年)が、1808年に「気体反応の法則」を提唱したフランス人化学者ジョセフ・ルイ・ゲイ=リュサック(1778~1850年)が、それぞれ化学反応を定量的に眺めたことで、定量的な実験や法則が明らかになり、定性的な手法では隠れていた「原子」や「分子」が「1個、2個、・・・」と数えることができる姿を徐々に現してきて、20世紀に入ると、ドイツ人理論物理学者アルベルト・アインシュタイン(1879~1955年)が1905年に、「ブラウン運動の理論」で原子および分子の存在が実験的に証明出来る可能性を示し、その後フランス人物理学者ジャン・ペラン(1870~1942年)らが、ブラウン運動について精密な実験を行い、アインシュタインの理論と計算結果が一致することを確認して、原子や分子の存在が認識されました。
19世紀末から20世紀にかけて、「原子は、もうそれ以上細かく分けることができない、物質の一番小さい単位である」という自然科学の常識がひっくり返るような物理学上の新発見が続きました。
まず、1895年にドイツ人物理学者ヴィルヘルム・コンラート・レントゲン(1845~1923年)がX線を発見しました。これをきっかけに、1896年にフランス人物理・化学者アンリ・ベクレル(1852~1908年)がウラン(U)から放射線が出ていることを発見し、1898年にポーランド人物理・化学者マリー・キュリー(1867~1934年)らが放射性元素トリウム(Th)、ポロニウム(Po)、ラジウム(Rd)を続けて発見しました。さらに、1900年には、ドイツ人物理学者マックス・プランク(1858~1947年)が「黒体放射の周波数分布についての観測結果から物質が固定されたエネルギー準位しか取ることができないために光は物質と固定のエネルギー量しか交換することができない」とする量子仮説を、その後、1905年にアインシュタインが、ニュートン力学が矛盾をきたす光速度に近い速度で運動する物体の力学的挙動に対して、その実験事実によく整合するあらゆる慣性系間の等価性を公理とした物理学の理論である「特殊相対性理論」を発表しました。
ポロニウム(Po)やラジウム(Rd)などの放射性元素の発見は、それ以上分割できない不生・不滅の粒子としてのアトム(原子)という旧来の知識を一変させ、それまでの、「原子は決して壊れない物」という考えが否定されました。
定量化学の発展によって「原子の粒子性」が明らかになり、放射性元素の発見によって「原子が他の原子に変化する」ことが明らかになると、原子の構造が化学者の興味の焦点となりました。
1897年、イギリス人物理学者ジョゼフ・ジョン・トムソン(1856~1940年)が真空放電の際にマイナス極から発生する「陰極線」の実験で、「電子」がすべての原子に共通して含まれていることを発見しました。1909年、「核物理学の父」と呼ばれた、イギリス人物理・化学者アーネスト・ラザフォード(1871~1937年)とドイツ人物理学者ハンス・ガイガー(1882~1945年)の指導の下で、イギリス人物理学者アーネスト・マースデン(1889~1970年)が真空中で鉛の塊の中にラジウムを入れ、一方向に向いた細い穴から「α粒子(ヘリウム4の原子核)」を薄い金属箔に向けて発射する実験を行い、いくつかのα粒子が線源方向に跳ね返ることを確認しました。この実験結果からラザフォードは、「原子が占める空間はスカスカで、中心にα粒子と反発するプラス電荷を持つ原子核があり、原子核は原子全体と比べるととても小さい」ことを予想して、原子核のまわりを電子が回っている「原子模型」を提唱しました。しかし当時の電磁気学によれば、このような電子はエネルギーを放出して軌道半径を漸減して、原子核に埋没してしまうことになります。これではすべての原子は中性子になって消滅してしまいます。この問題に対して、1913年、デンマーク人理論物理学者ニールス・ボーア(1885~1962年)が、理論と呼べる段階にない思い付きの仮設を立てました。半径「r」の軌道を速度「v」で円運動する質量「m」の物体は、ニュートン力学によれば「mvr」という運動量を持ちます。ボーアはこの運動量はどのような値でもとれるのではなく、整数「n」と光子のもつエネルギーと振動数の比例関係をあらわす比例定数であるプランク定数「h」として運動量を「mvr=nh/2π」という決められた値しか取ることができない角運動と仮定しました。この仮説を承認すると、水素原子の発光スペクトルが完璧に説明されました。まさしく量子理論の考えですが、ボーアがこの仮説を提案したときには、まだ量子理論は生まれていない時期でした。ラザフォードの原子模型における矛盾を解消したボーアの原子模型が、原子構造の基礎的な考えとして現在も用いられています。
量子化とは、古典力学では連続量として理解されていた物理現象を、「量子」ひとつひとつの集合体である離散的な物理現象として解釈し直すことです。水で考えると、水道の蛇口から流れ出る水は連続量です。どのような量でも自由に汲み取ることができます。しかし、自動販売機で売っているPETボトルの水は、だいたい500mLです。その時、300mLだけ欲しかったとしても、1本500mL単位で買わなければなりません。800mL欲しかったら2本1000mL買わなければなりません。これが量子化です。
ただし、このような「量子」が明瞭な形で現れるのは光子、電子、原子、分子など、微小な微粒子の世界においてだけです。
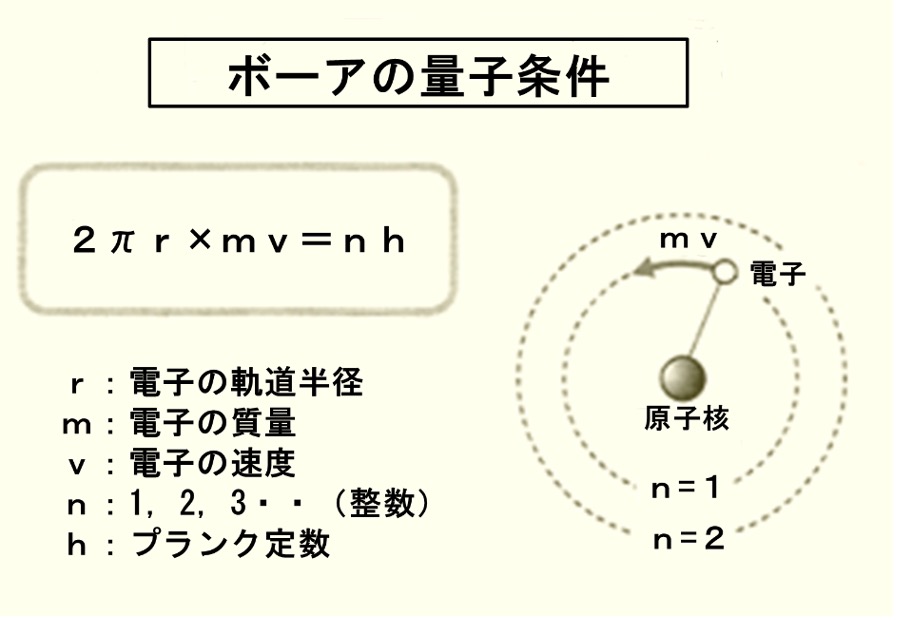
その後、1932年、イギリス人物理学者ジェームズ・チャドウィック(1891~1974年)によって原子核はプラス電荷を持つ「陽子」と、電気的に中性の「中性子」からなることが発見されました。そして、原子核に含まれる陽子の数は元素によって決まり、この数を「原子番号」と、原子の質量は電子が極めて軽いために陽子と中性子の数で決まり、陽子と中性子の数の和を「質量数」と呼ぶようになりました。
1927年、ドイツ人理論物理学者ヴェルナー・カール・ハイゼンベルク(1901~1976年)によって、微粒子の世界では、粒子の持つエネルギーを正確に表現しようとしたら、その粒子の位置は曖昧にならざるを得ず、反対に粒子の位置を正確に表現しようとするとエネルギーが曖昧になり、「2つの量」を同時に正確に決定することはできないという「不確定性原理」が提唱されました。そのため、粒子の働きを運動エネルギーで表現する現代化学において、電子は波の性質が強く表れて、原子全体に広がって存在し、その存在確率を視覚化した濃淡のある「電子雲」が原子を取り巻いている原子モデルで表されるようになりました。
1924年、フランス人理論物理学者ルイ・ド・ブロイ(1892~1987年)が、全ての物質が波動的性質を示すことがあり、その逆で波も粒子の性質を示すことがあるとする、「物質波(ド・ブロイ波)」の理論を提唱しました。ド・ブロイは、霧箱の実験で電子が粒子であることを示し、光電管の実験で光が電子と同じように粒子性を持っていることを示したことで、「全ての物質は粒子としての側面と、波(波動)としての側面を併せ持つ」と発表しました。
この理論により、光電効果とボーアの原子模型を共通の原因から説明することができました。原子核の周りの電子軌道は、波長・周期・振幅・速さが同じで、進行方向が互いに逆向きの2つの波が重なり合うことによってできる、波形が進行せずその場に止まって振動しているようにみえる波動を持つ「定在波」と考え、この考え方による計算上の電子の波長と、ボーアの原子模型における軌道の周長はよく一致することが確かめられました。しかし、水素以外の原子スペクトルの説明は依然としてできませんでした。
ド・ブロイ理論は三年後に、二つの独立に行なわれた電子の回折を検証する実験により確認されました。 イギリス人物理学者ジョージ・パジェット・トムソン(1892~1975年)は、金属薄膜に電子線を透過させ、ド・ブロイが予測した干渉縞を観測しました。同様の実験は、ベル研究所のアメリカ人物理学者クリントン・デイヴィソン(1881~1958年)らにより、既に1921年にニッケルによる電子線反射回折を用いて行われていましたが、そのころはまだ干渉と解釈されていませんでした。デイヴィソンと助手のアメリカ人物理学者レスター・ガーマー(1896~1971年)は、1927年に再実験を行い、観測された明瞭な回折パターンをド・ブロイの物質波理論を用い説明しました。
現代的な量子力学の端緒は、1926年、オーストリア人理論物理学者エルヴィン・シュレーディンガー(1887~1961年)が、ド・ブロイの物質波理論から波動力学と波動関数と呼ばれる量子力学における基礎方程式である「シュレーディンガー方程式」を発表したことです。シュレーディンガーは、波動関数は電子など量子力学で取り扱う対象の状態が時間変化すると考え、ある状況の下で電子などが取り得る量子状態を決定し、また系の量子状態が時間的に変化していくかを記述しました。
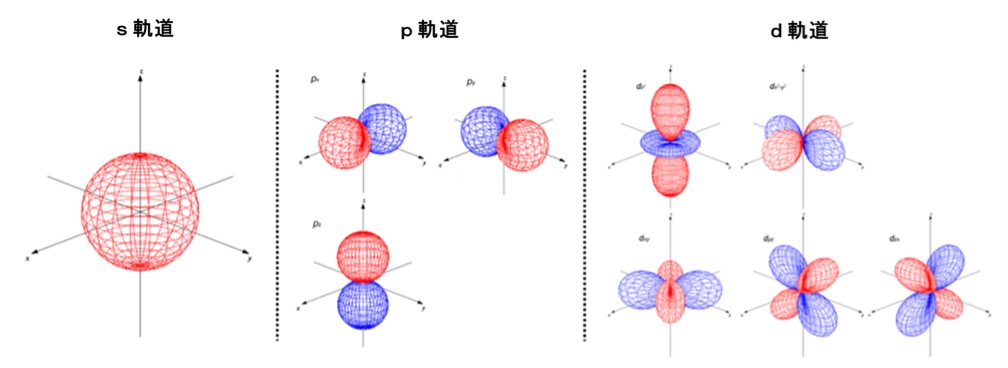
原子に属する電子の挙動は、その波動に係わる物理量の振動を空間座標と時間の関数として表した波動関数で表されます。軌道には、軌道エネルギーというエネルギーが付随しており、軌道エネルギーは波動関数で量子化され、「1s<2s<2p<3s<3p<3d・・・」と決まったエネルギー値の順に高くなります。電子はエネルギーの低い軌道から順に2個ずつ入っていきますが、軌道には電子の収容数が決まっており、1つの軌道に3個以上の電子が入ることはできません。
翌1927年に、ユダヤ系ドイツ人物理学者ヴァルター・ハイトラー(1904~1981年)とドイツ系アメリカ人物理学者フリッツ・ロンドン(1900~1954年)は、波動関数を水素分子へ適用し「共有結合」の説明に成功しました。その後、このハイトラー・ロンドン理論は、アメリカ人理論物理学者ジョン・クラーク・スレイター(1900~1976年)とアメリカ人量子化学者ライナス・ポーリング(1901~1994年)によってVB法(原子価結合法)へと発展しました。また、化学結合を取り扱う別の方法として、ドイツ人物理学者フリードリッヒ・フント(1896~1997年)とアメリカ人化学者ロバート・マリケン(1896~1986年)によりMO法(分子軌道法)が生み出されました。真の波動関数に対する近似として、VB法とMO法はスタート地点が異なるものの、相補的といえる関係にあり、計算精度と扱いの簡便さから、現在ではVB法よりもMO法がよく用いられています。
原子間の結合は原子の軌道の重なりによってできると考えられ、2個の水素原子が近づくと結合性軌道と反結合性軌道の2つの分子軌道が形成されます。そして水素原子が持っていた1個ずつの電子は共有の分子軌道に入り、この電子が共有結合を形成します。
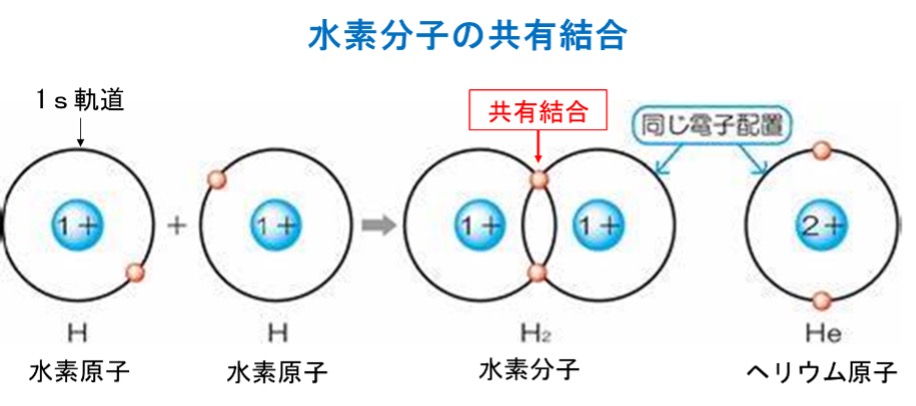
分子中の化学結合を説明するためにMO法では、分子軌道ダイアグラムが用いられます。原子が結合し分子を作る時に一定数の原子軌道が組み合わさり同数の分子軌道を形成しますが、関与する電子は軌道間で再配分できます。分子軌道ダイアグラムを用いると、何ゆえある分子は存在できるが一方は存在できないのか、結合がどの程度強いのか、そしてどの電子遷移が起こり得るのかを説明できます。
下記、分子軌道ダイアグラムでは、2つの原子軌道が左側および右側に描かれています。縦軸は軌道エネルギーを表わします。それぞれの原子軌道は、電子を表わす上向きあるいは下向き矢印で一つずつ占められています。
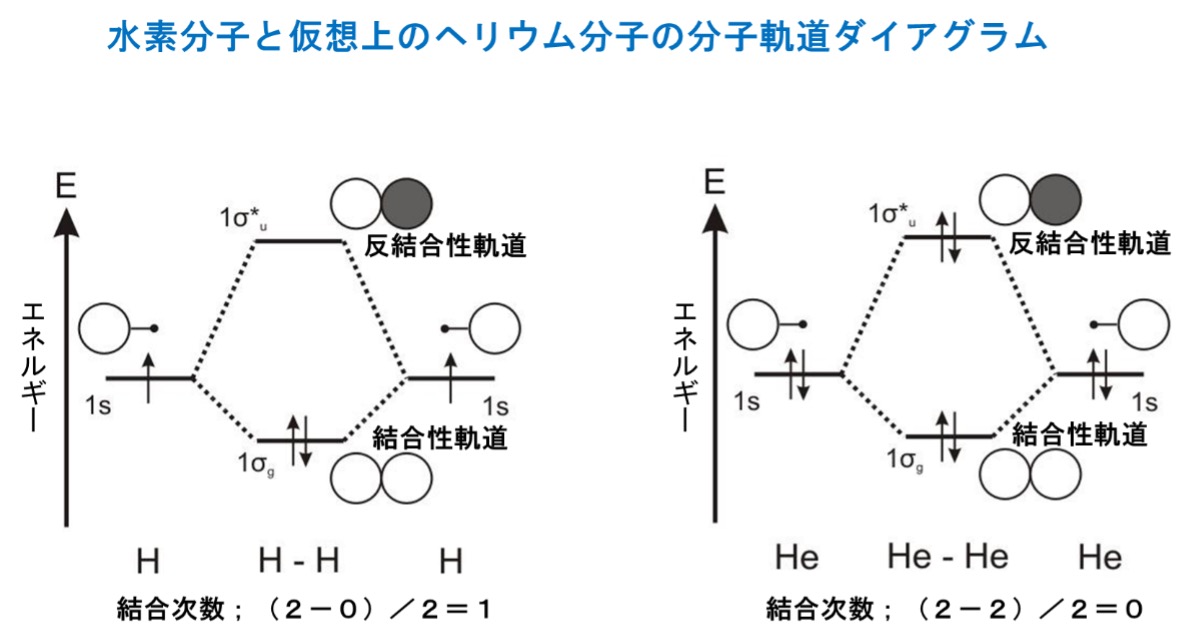
例えば、最も小さな分子である水素分子は、2つの水素原子間に1つの共有結合を有する水素分子(H-H)として存在しています。それぞれの水素原子は1つの電子に対する1つの1s原子軌道を有しているため、これら2つの原子軌道の重なり合いによって共有結合が形成されます。
水素分子に対するMO理論の応用によって、2つの電子は電子配置1σgを有する結合性軌道中に入り、水素分子に対する結合次数は「(2-0)/2=1」となり、2つの水素原子の結合間には単結合が1つ存在します。結合次数とは、存在する単結合の数です。結合次数は結合性電子の数と反結合性電子の数を差し引いて2で割った数と等しくなります。水素分子にエネルギーを与えた時、結合性軌道中の1個の電子に反結合性軌道に上がる分子電子遷移が起こり、結合次数は「(1-1)/2=0」となり共有結合は打ち消されます。
貴ガス元素は単原子分子であり、1原子が単独で存在することが知られています。ヘリウム 分子(He-He)は仮想上の分子であり、なぜヘリウム分子が自然界に存在しないかをMO理論によって説明することができます。上記ヘリウム分子の分子軌道ダイアグラムより、それぞれのヘリウム原子は2つの電子に対する1つの1s原子軌道を有しているため、これら2つの原子軌道の重なり合いによって共有結合が形成されると仮定します。水素分子の分子軌道ダイアグラムと非常に似ているように見えますが、この場合は新たに形成された分子軌道に入る電子が2個ではなく4個となります。電子はエネルギーの低い順に、1つの軌道に2個という電子の収容数を守って入ります。これを達成する唯一の方法は結合性ならびに反結合性軌道をどちらも2つの電子で満たすことであり、結果として結合次数は「(2-2)/2=0」となり、結合エネルギーの安定化は打ち消され2つのヘリウム原子は結合できません。
この様に、MO理論によって、分子中の化学結合を説明することができます。
量子化学の発展により、それまでは理論的説明付けが困難であった、分子分光学の電子スペクトル、振動スペクトル、回転スペクトル、核磁気共鳴スペクトルなどの性質と分子構造と関連付けや、共有結合や分子間力の原理の解明、フロンティア軌道と呼ばれる軌道の密度や位相によって、分子の反応性が支配されているとするフロンティア軌道理論を代表とする半定性的な化学反応の理解など、他の化学分野への貢献は大きなものがありました。
1980年代以降の急速なコンピュータの処理速度の増大と、それに伴う情報処理に関連する科学技術の発展は、計算によって理論化学の問題を取り扱う分野にも波及し、変分法より発展した基礎物理定数以外の実験値に依存しない量子力学に基づいた計算手法により精密な解を求めることが可能になりました。
近年においては量子化学により化学結合と分子の微細構造との関連、分子間相互作用や励起状態の解明、反応のポテンシャルエネルギー面を予測することで化学反応の特性を予測するなど定量的な予測が可能になり。同時に量子化学の適用対象も簡単なモデル化した分子だけではなく、実際の有機化合物、錯体化合物、高分子・生体関連物質、固体表面での界面化学の解析など多種多様の化学分野に及んでいます。
文献:
ウィキペディア・フリー百科事典
「量子化学」「量子力学」「粒子と波動の二重性」「アルベルト・アインシュタイン」「ジャン・ペラン」
「ヴィルヘルム・コンラート・レントゲン」「アンリ・ベクレル」「マリー・キュリー」
「マックス・プランク」「特殊相対性理論」「ジョゼフ・ジョン・トムソン」「アーネスト・ラザフォード」
「アーネスト・マースデン」「ニールス・ボーア」「量子化」「ジェームズ・チャドウィック」
「ヴェルナー・カール・ハイゼンベルク」「不確定性原理」「ルイ・ド・ブロイ」
「ジョージ・パジェット・トムソン」「クリントン・デイヴィソン」「レスター・ガーマー」
「エルヴィン・シュレーディンガー」「シュレーディンガー方程式」「ヴァルター・ハイトラー」
「フリッツ・ロンドン」「ジョン・クラーク・スレイター」「ライナス・ポーリング」
「フリードリッヒ・フント」「ロバート・マリケン」「原子価結合法」「分子軌道法」「分子軌道ダイアグラム」
「結合次数」「単原子分子」「フロンティア軌道理論」
2024年5月1日
「化学の泉」投稿文(その28)/豆知識(はじまりシリーズ)
【定量化学の法則と原子・分子の歴史】
化学は「物質」を研究する学問です。古代の人々も、「物質とはどのようなものか?」について考えていました。古代ギリシアの哲学者デモクリトス(紀元前460年~紀元前370年)は、彼の師であるレウキッポス(生没年不詳)の原子論を継承し、完成させたといわれています。この古代原子論は、「目には見えず、それ以上分割することができない原子(アトム)が、無限の空虚(ケノン)の中を運動することによって、世界が成り立つ」とする説です。この説の重要なところは、「物質」である原子と、「真空」に相当する空虚をすでに考えていたことで、この考えは現代の物質観に通じるものがあります。ただし、古代の物質観の特徴は「観念的なもの」で、そこには「考える」という姿勢はあっても、その考えを確認する力と意思と道具はありませんでした。自分が知っている知識や世界の範囲内で矛盾がなければ、それで理論は完成したと考えられていました。
ギリシア七賢人の一人とされるタレス(紀元前624~546年)のように「万物の“もと(元素)”はたった一つである」と限定するのには無理がある、と考えた哲学者エンペドクレス(紀元前490~430年)は、「火、空気、水、土」の4つが循環して世界をつくる「四元素説」を提唱しました。その後、四元素説は西洋、東洋を問わずに支持され、中世アラビアのイスラム文化圏の錬金術に多大な影響をもたらしました。4つの元素の間には「プラトンの正多面体」と呼ばれる循環があり、「火」は凝結して「空気」になり、「空気」は液化して「水」になり、「水」は固化して「土」になり、「土」は昇華して「火」になるとする説です。
「土、水、空気の3元素が物質をつくる」という考え方は、現代化学の固体、液体、気体の元素はすべてこの「3元素」の中に含まれるという見方に似ています。「火」に相当する元素とは、近代西洋化学ではドイツ人の医師で化学者であったゲオルク・エルンスト・シュタール(1659~1734年)が「燃焼はフロギストンという物質の放出の過程である」と提唱し、燃焼をつかさどる元素「フロギストン」の名前を残しました。また、現代化学では「火=エネルギー」となり、アインシュタインの式「E=mc2」が意味するところの「E(エネルギー)はm(質量)すなわち物質とc(光速)の二乗の積」であり、エネルギーと物質は変換可能と考えられています。
12世紀にイスラム文化圏で発展した錬金術の文書がラテン語に翻訳され、ヨーロッパでも盛んに研究され、ヨーロッパの化学の基礎を作りました。錬金術師は実際に各種の物質をいじり、操作し、元の物質を変化させ、その様子を克明に観察しました。そして、このプロセスから、実験的な化学が生まれてきました。
実験には、「定性的な方法」と「定量的な方法」があります。定性的な方法は「物質の変化の様子」だけを問題にします。これに対して、定量的な方法では物質の変化を見るだけでなく、その「量の変化」をも問題にします。「2H2+O2→2H2O」という反応に対して、定性的表現では、「水素と酸素が反応して、水(水蒸気)ができた」となりますが、定量的表現では、「4gの水素(2mol)と32gの酸素(1mol)が反応して、36gの水(2mol)ができた」となります。定性的な手法では、水素や酸素や水の概念だけで、反応の真の姿である反応式の係数、「2H2」や「2H2O」の「2」は見えてきません。つまり、原子の個数が見えないということで、原子は見えてきません。定量的な手法が持ち込まれたことで、原子の顔が見えはじめ、反応する原子の個数の比を問題にした、いくつかの法則が提唱されるようになりました。
ところで、定量的な取り扱いをしようとすると、「量」を測定しなければなりません。「量」を測定するためには、ある程度正確な計り、升、メスシリンダーなどの「秤量器」が必要です。人類の量の観念は数の観念と並行して度量衡制度として発達してきました。度量衡制度は、特に国内一律の徴税や金貨や銀貨などの秤量貨幣の正確な計量が主な目的で、支配者が徴税の基準を定めたり、大規模な建築を行ったり、天文や気象の知識に基づく権威保持のために用いられてきました。計量は客観的な基準がなければ困難であり、計量の基準には時間的普遍性、空間的不変性、再現性がもとめられ、その目的で、ある程度正確な計量のための秤量器が発達してきました。
このような秤量器が生まれる前では、化学で定量的な観測や実験をしたくても、することができませんでした。実際に、秤量器が使われはじめたのは、近代もかなり後半になってのことでした。それ以前の化学は、もっぱら定性的な手法でのみ、化学が進行してきたといえます。近代前期までの化学が原子ではなく、「元素」を前提にしていた理由は、秤量器が無いことにありました。
最初に、定量化が化学を大きく飛躍させた法則は、フランス人の化学者アントワーヌ・ラヴォアジエ(1743~1794年)が、1774年に「化学反応の前後において、物質の総質量は変化しない」と提唱した「質量保存の法則」でした。ラヴォアジエの時代には、燃焼とは一種の分解現象で、燃焼物中に含まれていたフロギストンが飛び出してきて、熱や炎となると考えられていました。しかし、この燃焼現象を定量的に考えると大きな問題があります。一般に、植物などが燃えると軽くなりますが、金属が燃焼すると、金属灰は重くなります。燃焼によってフロギストンが飛び出したのなら、残った金属灰は軽くなるはずです。この矛盾を説明するために、ラヴォアジエはリンの燃焼実験を行うことで「燃焼によって生成物の重量が増加する」ことを確認しました。その際、空気が吸収されることから、燃焼における重量増加の原因は、空気の吸収にあると考えました。その後、ラヴォアジエは酸化水銀を強熱して酸素を得る実験を繰り返し、燃焼の際の重量増加は結合する酸素の量に一致することを確認し、従来のフロギストン説を否定しました。その後、この考えから出発して、定比例の法則と倍数比例の法則が発見され、原子、分子および化学量論の概念が確立してゆくことになり、ラヴォアジエは「近代化学の父」と呼ばれるようになりました。
しかし、20世紀初頭にドイツ生まれのユダヤ人理論物理学者アルベルト・アインシュタイン(1879~1955年)は、時間や空間と慣性力に基づく考察から、時空間の観測や重力を体系的に論じた物理理論において「E=mc2」 という数式で、「質量は消滅してエネルギーに変化しうる」と提唱した相対性理論の有効性が明らかになると、質量保存の法則や物質不滅の法則は、自然の基本法則としては完全に破棄されることとなりました。
慣性系のみを扱う「特殊相対性理論」によれば、質量とエネルギーは等価であり、閉じた系において保存されるのは「質量の総和」ではなく「(質量を含む)エネルギーの総和」であるとされるために、化学反応によってエネルギーが吸収・放出されれば、それだけ質量も変化することになります。
ラヴォアジエの「質量保存の法則」の次に大きな発見がなされたのが「物質が化学変化するとき、反応に関与する物質の質量の割合は、常に一定である」と提唱された「定比
例の法則」です。定比例の法則は、1799年にフランス人の化学者ジョゼフ・ルイ・ブルースト(1754~1826年)によって発表されました。例えば水H2Oを構成する水素と酸素の質量の比は常に「水素:酸素=1:8」であるという説です。
ブルーストが研究した時代はラヴォアジエと同時代で、フランス革命の真っ最中でした。ラヴォアジエはフランス革命の動乱に翻弄され、ギロチンの露と消えましたが、ブルーストは革命の混乱を避けて一時スペインで研究したこともありました。
定比例の法則に対しフランス人の医師で化学者のクロード・ルイ・ベルトレー(1748~1822年)は、鉱物の組成などを例にあげ、化合物を構成する成分元素の比は産地や製法によって変化するとして反対しました。当時はまだ混合物と化合物の違いが明確に区別されていなかったため、ベルトレーの考え方が主流でした。プルーストはこれに対し、炭酸銅(CuCO2)が鉱物のクジャク石から得られたものも実験室で合成したものも同じ組成を持つことや、酸化銅(CuO)や酸化スズ(SnO2)に2種類のものがあることを示し、組成が変化するように見えるのはこれらの混合物であるためであることを示し反論しました。
定比例の法則は、倍数比例の法則を提唱したイギリス人の化学者で物理学者のジョン・ドルトン(1766~1844年)が、「原子説」を提唱する際にその根拠の1つとして「一定の質量比率の原子の相互作用によって化学反応が起きる」と発表したことで受け入れられました。
2種類の元素が化合して2種類以上の化合物をつくる場合の「倍数比例の法則」は、1802年にドルトンによって、自身が提唱した原子説の有力な証拠として「化合物の間では、一方の元素の同一質量と結合する他の元素の質量は簡単な整数比を示す」と発表されました。
例えば、炭素と酸素からなる2つの化合物として、一酸化炭素と二酸化炭素をとりあげた場合、一酸化炭素(CO)28gと二酸化炭素(CO2)44gは、それぞれ同量の炭素(C)12gを含んでいます。一酸化炭素(CO)28gには酸素(O)16gが含まれ、二酸化炭素(CO2)44gには酸素(O2)32gが含まれます。すなわち、一定量の炭素を含む一酸化炭素と二酸化炭素それぞれに含まれる酸素の質量の比は、「1:2」という簡単な整数の比で表されます。炭素原子1個に対して酸素原子が1個結合した化合物が一酸化炭素(CO)であり、炭素原子1個に対して酸素原子が2個結合した化合物が二酸化炭素(CO2)です。原子はそれ以上分割できない粒子であるため、炭素原子1個に対し酸素原子が非整数個結合したような化合物が存在しません。そのため元素Aを含む複数の元素が、複数の化合物、例えばXとYを構成するときにX、Yそれぞれに含まれるAの質量は簡単な整数比になり「倍数比例の法則」が成立します。
その後1808年に、2種以上の気体物質が関与する化学反応について成立する「化合物の間では、一方の元素の同一質量と結合する他の元素の質量は簡単な整数比を示す」という「気体反応の法則」が、フランス人の化学者ジョセフ・ルイ・ゲイ=リュサック(1778~1850年)によって発表されました。2種以上の気体が関与する化学反応について、反応で消費あるいは生成した各気体の体積には同じ圧力、同じ温度のもとで簡単な整数比が成り立つという法則です。
例えば、水素と酸素が反応して水蒸気ができる場合、これらの体積の間に
[反応で消費される水素] : [反応で消費される酸素] : [反応で生成する水蒸気] =2:1:2
という関係が成立します。これは現在知られている化学反応式「2H2+O2→2H2O」の係数に対応しています。
同様に、水素と窒素が反応してアンモニアができる場合、
[反応で消費される水素] : [反応で消費される窒素] : [反応で生成するアンモニア] = 3:1:2
という関係が成立します。これもやはり、化学反応式「3H2+N2→2NH3」の係数に対応しています。
スウェーデン人の医師で化学者のイェンス・べルセリウス(1779~1848年)は、気体反応の法則の体積比が各化合物の粒子の数の比と対応していることを見いだし、多くの化合物の組成式を推定し、さらにそこから「1個の原子の質量の原子質量単位」に対する比によって定めた原子の質量である「原子量」を推定しました。ベルセリウスの考えに従うと「同じ圧力、同じ温度、同じ体積の気体には同じ数の粒子が含まれる」ということになります。しかし当時は水素や酸素は原子1個からなると考えられていたため、これをあらゆる気体に適用するならば、水素原子2個、酸素原子1個から水分子2個が生成しなければならず、原子の数に矛盾が発生してしまいました。そのために、気体反応の法則が受け入れられたのは、その発表から50年も経ってからでした。
「水素ガスや酸素ガスの分子は、“H”、“O”なのか?“H2”、“O2”なのか?水の分子は“HO”なのか?“H2O”なのか?」このことがはっきりしないと正しく「原子量」を決めることができません。
この矛盾を解消したのは、1811年にサルデーニャ王国(イタリアのトリノ)の物理学者で化学者のアメデオ・アヴォガドロ(1776~1856年)が、ゲイ=リュサックの気体反応の法則とジョン・ドルトンの原子説の矛盾を説明するために仮説として提案した「同一圧力、同一温度、同一体積のすべての種類の気体には同じ数の分子が含まれる」という「アヴォガドロの法則」でした。また特に「水素や酸素が2つの原子が結合した分子からなる」という「分子」という概念を提案した点に着目して「分子説」とも呼ばれます。アヴォガドロが分子の概念を発表したことで大きく進展して、「分子」は、「原子が結びついてできている物質の基本構造単位」となりました。
つまり、原子も分子も「これ以上分けられない微粒子」ですが、分子はその物質の性質を残した微粒子であり、原子は分子を分割して出てきた微粒子で物質の性質はありません。また、原子と元素の違いは、粒子という具体的な物質を指す場合を「原子」と呼び、概念を指す場合は「元素」と呼ぶようになりました。
このことから、1869年にロシアの化学者ドミトリ・メンデレーエフ(1834~1907年)の提案で、元素を原子量の小さい順に並べた周期表がつくられ、原子説は多くの科学者に支持されました。しかし、原子や分子の存在は、まだ「仮説」に過ぎません。「原子・分子が存在するか?」は化学の大問題でした。
その問題を解決したのがアインシュタインが提唱した「ブラウン運動の理論」でした。ブラウン運動は、1827年にイギリス人の植物学者ロバート・ブラウン(1773~1858年)が、水の浸透圧で破裂した花粉から水中に流出し浮遊した微粒子を、顕微鏡下で観察中に発見した、液体や気体中に浮遊する微粒子が、不規則に運動する現象で、長い間原因が不明のままでした。
1905年に、アインシュタインにより、「(ブラウン運動は)熱運動する媒質の分子の不規則な衝突によって引き起こされている」という論文が発表されました。「ブラウン運動の理論」は、微粒子の重さや大きさが異なると、起こる不規則な運動の仕方は変わるという理論で、当時不確かだった原子および分子の存在が、実験的に証明出来る可能性が示されました。
その後、フランス人の物理学者ジャン・ペラン(1870~1942年)らが、ブラウン運動について精密な実験を行い、アインシュタインの水の分子が運動するという理論と計算結果が見事に一致したことから、顕微鏡で観察できる微粒子のブラウン運動は、水の分子の激しい運動であることが証明されました。このことで、原子・分子の存在が科学者の間で信じられるようになりました。
18世紀後期以降に、ラボアジェ、プルースト、ドルトン、ゲイ=リュサックらが、化学反応を定量的に眺めたことで、定量的な実験や法則が明らかになり、定性的な手法では隠れていた「原子」や「分子」が「1個、2個、・・・」と数えることができる姿を徐々に現してきて、ついに、20世紀にその存在が認識されるようになりました。
文献:
ウィキペディア・フリー百科事典
「原子論」「分子論の歴史」「デモクリトス」「レウキッポス」「タレス」「エンペドクレス」「四元素説」
「ゲオルク・エルンスト・シュタール」「秤」「計量」「度量衡」「アントワーヌ・ラヴォアジエ」
「質量保存の法則」「アルベルト・アインシュタイン」「相対性理論」「ジョゼフ・ブルースト」
「定比例の法則」「クロード・ルイ・ベルトレー」「ジョン・ドルトン」「倍数比例の法則」
「ジョセフ・ルイ・ゲイ=リュサック」「気体反応の法則」「イェンス・べルセリウス」「原子量」
「アメデオ・アヴォガドロ」「アヴォガドロの法則」「ドミトリ・メンデレーエフ」「ロバート・ブラウン」
「ブラウン運動」「ジャン・ペラン」
2024年4月1日
「化学の泉」投稿文(その27)/豆知識(はじまりシリーズ)
【火薬の歴史】
火薬とは、熱や衝撃などをきっかけにして、急激な燃焼反応をおこす物質です。火薬の燃焼が通常の燃焼と異なる点は空気中の酸素を必要としないことです。例えばニトログリセリンでは炭化水素に結合した硝酸エステル(-O-NO2)が酸化剤の役割になっています。また、黒色火薬のような混合火薬では、燃料に硝酸カリウムなどの酸化剤を混合していて、黒色火薬に含まれる炭、炭素を燃料とし、硝酸カリウムは酸化反応を高速にする役割を果たしています。
「火薬類」とは、利用価値のある爆発物であり、「火薬」、「爆薬」、「火工品」に分けられます。「火薬」は、燃焼を利用するものであり、「爆薬」の方は気体の急速な熱膨張の速度が音速を超え、衝撃波を伴いながら燃焼する「爆轟(ばくごう)」を利用するものです。「火薬」の方は、爆燃による急激なガスの発生・膨張を利用して弾の発射などに利用するものであり、それに対して「爆薬」の方は、火薬よりもさらに速い速度の燃焼(爆発)による衝撃波で何かを破壊するために利用するものです。「火工品」は、火薬または爆薬を使用目的に応じて加工したものです。「火薬」には、銃砲用発射薬やロケット推進薬などがあります。銃砲用発射薬には黒色火薬、無煙火薬などがあります。 爆薬のうち特に敏感で、わずかな衝撃、摩擦または点火などによって容易に爆轟を起すものを「起爆薬」といい、化学的にはアジ化鉛、アセチレン銀、ジアゾジニトロフェノールなどがあります。それ以外の爆薬にはダイナマイトやトリニトロトルエンなどがあります。
木炭と硫黄、酸化剤としての硝酸カリウム(硝石)の混合物からなる黒色火薬は、10~11世紀に中国で発明されたというのが定説です。唐代(618~907年)の錬金術の副産物と考えられています。
1132年に、満州から中国北半にかけての地域を支配した女真族の征服王朝である金(1115~1234年)との戦争中に起きた内乱に対して火薬兵器である火槍(かそう)を南宋(1127~1279年)が敵方の建築物に火を放ったり、威嚇用として使用したと言われています。後に金王朝は、鉄製の容器に火薬を詰めて点火して、投石機で敵軍に打ち込んで、1232年に侵入してきたモンゴル軍を撃退しました。モンゴル軍は手痛い経験に学んで黒色火薬を用いるようになり、13世紀後半の元寇において日本人は初めて火薬を用いた兵器に遭遇しました。また、1250年代にモンゴル軍がイランに侵攻した際、中国人技術者が操作する投石機で、火薬弾が用いられています。
また、1288年当時の青銅製の銃身が発掘されたことで、モンゴル支配下の中国が火槍から銃へ装備を変えたことが明らかになり、さらにこれまで銃は西欧発明と考えられていましたが、銃はモンゴル帝国を通じて、ヨーロッパへ伝わったと見られています。1326年にはイタリアのフィレンツェで大砲が開発され、以後、ヨーロッパでは大砲が発達しました。イベリア半島では1330年代までに、銃だけでなく大砲が戦闘に用いられています。鉄砲は、1381年に南ドイツで出現し、15世紀後半には実用化され16世紀には普及しました。黒色火薬は大砲や鉄砲に使用され、戦場における戦い方を変化させました。火砲が戦闘で用いられるようになり、騎士の騎馬戦術は意味をなさなくなり、騎士階級の没落を促し、戦闘の主力は鉄砲で武装した歩兵集団に移っていきました。
14世紀には、イングランドやドイツに火薬工場が作られました。エリザベス1世(1558~1603年)の時代、火薬製造はイングランド王室の専売事業でした。それ以外にもヨーロッパの多くの国で火薬製造は非常に重要な軍需産業となり、国家の様々な保護を受けました。こうした火薬製造において、原料のうち、木炭はどこでも手に入れることができるものであり、硫黄も入手はそれほど難しいものではありませんでしたが、硝石の入手には各国とも非常に苦心しました。1378年にはドイツのニュルンベルクにおいて、風通しのいい小屋に窒素を含む木の葉や石灰石・糞尿・塵芥を土と混ぜて積み上げ、定期的に糞尿をかけて硝石を析出させる「硝石丘法」が発明され、これがヨーロッパ諸国に伝わってある程度の硝石の生産が可能になりました。しかし、増加する火薬の需要にはとても追いつかず、硝石の生産量が火薬生産のボトルネックとなる状況が数百年続きました。火薬による兵器、すなわち銃と砲はオスマン帝国やヨーロッパ諸国の戦闘を激変させるとともに、ヨーロッパ世界やイスラム世界がアメリカ大陸やアフリカ大陸の諸国や地域を征服することに大きな力を発揮しました。
火薬技術は19世紀までは停滞傾向にありましたが、19世紀に入ると次々と技術革新があらわれ、火薬は大きく変化しました。まず、1820年ごろにチリのアタカマ砂漠において広大なチリ硝石の鉱床が発見され、安価なチリ硝石の大量供給によって火薬生産のボトルネックが解消され、火薬の生産が増加しました。またこれによって、硝石丘を使った土硝法による硝石生産は全く姿を消しました。
黒色火薬は、19世紀の半ば頃まで使われていました。鉱山の開発などにも強力な火薬が要求されましたが、黒色火薬には、濡れると発火しない、煙がひどい、爆発力もそれほど強くないなどの欠点がありました。このためヨーロッパ各国の軍隊や産業界は、新しい強力な火薬の出現を待ち望んでいました。
1845年、ドイツ人化学者クリスチアン・シェーンバイン(1799~1868年)によってニトロセルロース(綿火薬)が発明されました。これは、綿に硫酸と硝酸の混合物を混ぜて反応させてつくられました。爆発力は黒色火薬よりもはるかに強いものの、爆発しやすかったために、火薬工場や倉庫の大爆発事故が多発して、使いづらい火薬でした。
1847年、イタリア人化学者アスカニオ・ソブレロ(1812~1888年)によってニトログリセリンが発明されました。ニトログリセリンは、グリセリン分子の3つのヒドロキシ基を、硝酸と反応させてエステル化させた無色透明の液体状の物質で、叩いたり、熱を加えたりすると、ものすごい勢いで爆発しました。少々のショックで爆発してしまうので運搬や保存が難しく、ニトロセルロースと同様に使いづらい火薬でした。ところで、ニトログリセリンを製造する工場の労働者たちが激しい頭痛を訴えたことで、頭痛の原因がニトログリセリンを扱ったことで血管が拡張したことが原因であると判明し、転じて、ニトログリセリンは心臓の筋肉へ血液を送る血管が狭くなる「狭心症」患者の薬として利用されるようになりました。
黒色火薬は1/1000秒で6000気圧の圧力が生じますが、ニトログリセリンは1/100万秒で27万気圧の圧力が生じます。この様に、ニトログリセリンは巨大な爆発力を持っているので、ショックや熱で爆発してしまうことを回避する安全な使用方法が研究されました。
1862年、スウェーデン人の化学者で実業家のアルフレッド・ノーベル(1833~1896年)は、当時ヨーロッパで話題になっていたニトログリセリンの小さな工場を家族で作りましたが、大変な爆発事故を起こし、工場は破壊され末の弟を含め5人の労働者が死亡しました。1866年、ノーベルは残った家族と協力して、ニトログリセリンを安全なものにしようと研究し、ケイソウ土に染み込ませると安全性が増し、扱いやすくなることを発見しました。さらに起爆薬として雷管を使うことで、爆発力を維持することもできたので、ダイナマイトとして市場に出しました。その後、ノーベルは、ダイナマイト以外にも無煙火薬バリスタイトを開発して、軍用火薬として世界各国に売り込み、さらに、ロシアにバクー油田を開発して、巨万の富を築きました。ノーベルの死後、彼の遺言で全財産を安全な有価証券に投資してノーベル財団を設立し、その利子を、その前年に人類のために最大の貢献をした人たちに、賞のかたちで分配されるものとし、1901年からノーベル賞の授与が始まりました。

ダイナマイトは、銃が激しい破壊力に耐えることができなかったため、弾丸の発射薬には使用できませんでした。黒色火薬は、発射の際に白煙と火薬カスがでるなどの問題点があり、各国の軍部は黒色火薬より強い発射薬を求める中、1886年にフランス人化学者ポール・ヴィエイユ(1854~1934年)が少量のニトロセルロースをエーテルとアルコールの混合液でゼラチン化した無煙火薬を発明しました。少量の綿状のニトロセルロースは点火すると煙無く、一瞬で燃焼し跡形もなくなります。ノーベルが開発した無煙火薬バリスタイトもその仲間です。1889年、イギリス人化学者フレデリック・エイベル(1827~1902年)とイギリス人の化学者で物理学者のジェイムズ・デュワー(1842~1923年)によって、ニトログリセリンとニトロセルロースに安定剤のワセリンを添加した物をアセトンで溶かして練って粒子状した無煙火薬コルダイトが発明されました。この登場で、コルダイト火薬が近代的な火薬の主流となりました。
発射薬には、拳銃弾や小銃弾に使用されるニトロセルロースと安定剤のみでできている「シングルベース火薬」、さらに爆発力が強い迫撃砲などの火砲弾に使用されるニトログリセリンを追加した「ダブルベース火薬」、そして強い威力と安全性が要求される大口径砲の火砲弾に使用されるニトログアニジンをその上に追加した「トリプルベース火薬」という区分があります。

また、弾丸の中に詰めて弾丸を炸裂させる炸薬の研究もおこなわれてきました。初めてトリニトロフェノールに言及した資料は、オランダ人の薬剤師で化学者のヨハン・ルドルフ・グラウバー(1604~1670年)が書いたとされる錬金術に関する文書でした。当初には動物の角、絹、インディゴ(藍色の染料)、樹脂のような物質をニトロ化することで、絹や羊毛の合成染料として作られました。その後、1871年にフェノールをニトロ化して得られるトリニトロフェノールが合成されました。その味が極めて苦い(ピクリック)ので、ピクリン酸とも呼ばれる明るい黄色の粉末でした。1873年、ドイツ系イギリス人化学者ヘルマン・シュプレンゲル(1834~1906年)がピクリン酸の爆発性を証明し、起爆薬があれば爆薬に使えることが分かり炸薬として使用されるようになりました。しかし、湿ると爆破しにくくなり、雨天や湿気の多い日には不発弾が多いという課題がありました。
1863年、ドイツ人化学者ジュリアス・ウィルブラント(1839~1906年) がトルエンと硝硫混合酸を使用して高温でニトロ化することで初めてトリニトロトルエンを合成しましたが、当時は黄色の染料として利用されており、爆薬としての可能性は認識されていませんでした。1891年にドイツ人科学者カール・ハウサーマン(生没年不詳)が、爆薬に使用できることを解明したことで、強力な炸薬トリニトロトルエン(TNT)が開発され、工業的規模での大量生産が開始されました。TNTは、トルエンのフェニル基の水素のうち3つをニトロ基(-NO2)で置換したピクリン酸と同じニトロ化合物ですが湿気に影響されないためピクリン酸よりも軍事的に優れていました。1901年にはピクリン酸に代わってTNTが主要な爆薬となりました。
1908年、ユダヤ系ドイツ人化学者フリッツ・ハーバー(1868~1934年)が、500℃、200気圧という高温・高圧の条件のもとで、オスミウム触媒を用いて、窒素と水素からアンモニアを合成することに成功しました。その後、ドイツBASF社の技術者カール・ボッシュ(1874~1940年)ら、ハーバーの研究仲間がハーバーの発明した方法の欠点を克服し、高価なオスミウムに代わる、より安価な触媒として、磁性酸化鉄を主成分とする触媒が最適であることを発見し、過酷な条件に耐えうる装置をつくりあげ、アンモニアの量産を可能としました。空気中の窒素を水素と直接反応させてアンモニアを合成するハーバー・ボッシュ法が工業化すると、アンモニアから硝酸が作られるようになり、この硝酸(HNO3)を濃縮して無水アンモニア(NH3)と酸塩基反応させることで硝酸アンモニウム(NH4NO3)が工業生産され、肥料や爆薬として使用されました。(HNO3+NH3→NH4NO3)
それまで、鉱山の爆破やトンネル工事などの爆破といえばダイナマイトの独壇場でしたが、硝酸アンモニウムの製造量が増加するとダイナマイトから安価な硝酸アンモニウムを主成分とする爆薬への切り替えが進んでいきました。
1956年、アメリカ人化学者メルビン・クック(1911~2000年)が硝酸アンモニウム、アルミニウム粉末、水からなる安全な爆薬を発明し、スラリー爆薬と名付けて事業化しました。スラリー爆薬には、硝酸アンモニウム94%と燃料油6%を混ぜた「アンホ爆薬」と、硝酸アンモニウムに5%以上の水を含む「含水爆薬」があります。破壊力は「アンホ爆薬>含水爆薬>ダイナマイト」の順ですが、アンホ爆薬はダイナマイトや含水爆薬と比較して1/3程度安価で安全性に優れているものの、耐水性に欠け、爆発後に有毒ガスが発生し、硬い岩盤を破壊するのが困難という欠点があります。含水爆薬は、スリラータイプとエマルジョンタイプがあり、ダイナマイトより安全性が高く、爆発後のガスは有毒性が低く、ダイナマイトより安価なために、ダイナマイトからの切り替えが進み産業爆薬の主流となりました。
硝酸アンモニウムは、適切に扱えば非常に安全な爆薬ですが、不適切な操作による事故やテロリストによる悪用によって数多くの悲劇的な爆破が起こっています。2020年8月4日、レバノン・ベイルートの港湾地区での大規模な爆発事故は、死者200名以上、怪我人6500名以上、およそ30万人が家を失ったと推計されています。現場になった倉庫には、およそ2750トンの硝酸アンモニウムが不十分な安全対策のままで6年間にわたり保管されていたことが、大規模爆発の原因になったと見られています。
火薬は、戦争においても平和においても、また、破壊においても建設においても、私たちの文明に大きな影響を与えてきました。
文献:
ウィキペディア・フリー百科事典
「火薬」「黒色火薬」「ニトログリセリン」「唐」「金王朝」「鉄砲」「エリザベス1世」「チリ硝石」
「クリスチアン・シェーンバイン」「アスカニオ・ソブレロ」「アルフレッド・ノーベル」
「ポール・ヴィエイユ」「フレデリック・エイベル」「ヨハン・ルドルフ・グラウバー」
「トリニトロフェノール」「ジェイムズ・デュワー」「コルダイト火薬」「Hermann Sprengel」
「Joseph Wilbrand」「トリニトロトルエン」「Carl Häussermann」「フリッツ・ハーバー」
「カール・ボッシュ」「硝酸アンモニウム」「Melvin Alonzo Cook」「含水爆薬」
2024年3月2日
「化学の泉」投稿文(その26)/豆知識(はじまりシリーズ)
【無機化学の歴史】
無機化学とは、研究対象として元素単体および無機化合物を研究する化学の一分野です。通常有機化学の相反概念として無機化学が定義されている為、非有機化合物を研究対象とする化学と考えて差し支えありません。
無機化学では基本的には炭素以外の周期表の全元素を取り扱いますが、炭素を含む化合物であっても有機化合物とは見なされない炭素の同素体や一酸化炭素などの化合物も含まれます。
有機化合物はおよそ地表にのみ存在するのに対して、地球はほとんどが無機物質で構成されているといっても過言ではありません。工業的にも鉄鋼やセメント、ガラスなどの無機工業製品は生産トン数で考えた場合には有機工業製品を圧倒的に上回っています。しかし、その多様性と複雑性のため、すべての元素の性質を簡単な理論で説明できるわけではありません。
錬金術の成果が書物として中世ヨーロッパに伝えられ、その博物学的知識の集合が近代化学の礎となりましたが、そのほとんどは無機化合物についての知見でした。また、化学自身を研究対象により分類し区別することもなかったため、18世紀以前は化学と無機化学は同義でした。
17世紀後半の頃、最初に酸塩基化学に関する理論を開発した一人であるフランス人化学者ニコラ・レメリー(1645~1715年)は、物質を鉱物酸、植物酸、動物酸に分類していました。しかしながら、18世紀後半に質量保存の法則を提唱して「近代化学の父」と呼ばれるフランス人化学者アントワーヌ・ラボアジェ(1743~1794年)は、有機物を特別とは考えずに無機物と一緒というように考えていました。ラボアジェは、化学を近代サイエンスとして築き上げた人ですが、徴税人として政府で働き、貴族であったがゆえにフランス革命の動乱に翻弄され、ギロチンの露と消えました。その時代は、水銀や酸素など無機物が主役であり、有機物と言えばオリーブ油や砂糖などの生物体から産出される特別な物質に限られていて、これらは加熱すると容易に煙を出して焦げ付いてしまうので、無機物のように強く燃焼させて、その酸化物を研究することは極めて困難なために、不明のまま取り残されていました。また、無機物は人の手で作り出すことができるけれど、有機物は生命体のなかで「生命力」という特別な作用によってのみ生産できるものであると信じられており、結局このことが無機物と有機物を区別する原則でした。
18世紀終わり頃から19世紀初頭にかけて、発見されるいわゆる有機化合物の種類が増加するにつれ、起源による物質の分類と研究対象による研究領域の区分が試みられるようになりました。1806年頃、近代化学の理論体系を組織化して集大成したスウェーデン人の医師で化学者のイェンス・ベルセリウス(1779~1848年)は、有機体を意味する "organ" から有機化学 (organic chemistry) や有機化合物 (organic compound) という語を初めて使用しました。それが学術語や学問領域として定着するにつれて、有機化学および有機化合物に相反する学問領域として無機化学と無機化合物という概念が生じました。
1828年になると、「有機物」の提唱者ベルセリウスの弟子であり、「有機化学の父」と呼ばれるドイツ人化学者フリードリヒ・ヴェーラー(1800~1882年)が、無機物であるシアン酸アンモニウム[NH4OCN]から有機物である尿素[(NH2)2CO]を人工的に作り出すことに成功しました。有機物である尿素が実験室の中で「生命力」なしに無機物から生産されることが発見されるに至り、無機物と有機物の間に区別がなくなってしまいました。この驚異的な出来事によって無機化学と有機化学の境界線が消えたまま現在に至っています。
この事件以来、多くの化学者が無機物よりも研究は困難であるが生命に関係していて神秘的であると考えられた有機物に興味を持つようになりました。19世紀中頃から20世紀にかけて著明な有機化学者が多数輩出され、有機化学の全盛時代を迎えたのはこのためでした。
無機化学は錬金術の時代から長い間研究されてきた分野ですが、この有機化学の隆盛によってようやく有機化学が無機化学と並ぶようになり、化学を二分する大きな勢力となって今日に至っています。
有機化学においては官能基により反応性または特性が大きく異なることから、無機化学に比べて早い段階から、官能基の研究を通じて構造論や反応論が展開してきました。一方、近代無機化学においては、周期律をはじめとする無機物や無機化合物の結晶構造の研究が中心でした。
周期律とは、元素を原子番号順に配列すると元素の物理的、化学的性質が一定の周期性で変化することです。周期律に従い元素を配列した表が周期表です。周期表を見ると、どの元素がどのような性質を示し、どのような反応性を示すか、かなりの精度で予想することができます。化学にとって欠かすことができない大切な表です。
周期表は、元素を原子番号順に並べた順列を基本的に18個ごとに折り曲げ、左から順に縦の列を1族、2族、3族、・・・18族と名前を付けたものです。元素をこのように整理すると、それぞれの「族」に属した元素は互いに似た性質を示すことが分かります。また、元素の大きさ(原子半径)は、基本的に左から右へ行くにつれて小さくなり、次の段(周期)に移るとさらに大きくなって、また右へ行くにつれて徐々に小さくなるという周期性を示します。このように、元素の性質を簡潔かつ完成度を高く示した周期表は「化学のバイブル」とも呼ばれています。
周期表は原子番号順によって配列されていますが、考案した当初は原子量によって配列していました。ごく一部の例外を除いて、元素の原子番号が増加するにつれて原子量も増加するため、原子量順に元素を配列することによってもほぼ同じように周期律が再現されました。
最初に原子量と元素の性質の間に関係があることに気が付いたのは、ドイツ人化学者ヨハン・デーベライナー(1780~1849年)であるとされています。デーベライナーは1826年に発見された臭素の色や反応における性質、そして原子量が塩素とヨウ素の中間にあることに気づき、同様の組み合わせが無いか研究して、「カルシウム→ストロンチウム→バリウム」と「硫黄→セレン→テルル」にも同じような性質の近似性があることを見つけ、この組み合わせを「三つ組元素」と名付けました。しかし当時は原子量と分子量、そして化学当量が明確に区分されていなかったために混同も多かったので、多くの化学者は単なる偶然と片付けてしまいましたが、この発見が周期律の発見される最初のステップとなりました。
18世紀のイタリア人物理学者アレッサンドロ・ボルタ(1745~1827年)の電池による電気分解や、1802年にイギリス人の物理学者で化学者のウィリアム・ウォラストン(1766~1828年)により、太陽光のスペクトルのなかに太陽の元素により吸収されてできる暗線(フラウンホーファー線)が発見されたことで発展した分光分析法などによって、新しい元素が続々と発見されるようになりました。
そんな時期に、ロシア人化学者ドミトリー・メンデレーエフ(1834~1907年)が、化学の教科書を執筆している際に、発見済みの数が63個にまで増えていた元素を説明する方法に悩み、自分が好きなカードゲームから発案して、元素名を書き込んだカードを原子量順に並べ替えることを何度も繰り返すうちに、原子価を重視し、かつ適切に当てはめられる元素が表中に無い場合には、仮の名をつけて元素を割り当てずに空けておくという工夫をして、ローマ数字ⅠからⅧで縦の分類を施し、うちⅠ~Ⅶを基本的に1~2族および13~17族に対応させ、Ⅷには遷移元素群を入れ、また貴ガスは反映させず、それぞれには2種類の亜族を設け、表の左右に振り分けて区分した周期表を提唱しました。
その後、ガリウムやゲルマニウムが発見されメンデレーエフの周期表の空白の位置を埋めるものだということが判明し、この周期表による予想の正しさが証明されました。
20世紀に入ると、希土類元素や貴ガス類元素が発見され、周期表における位置が決定されました。
さらに、周期律における位置は、陰イオンをつくりやすいハロゲン元素の次にイオンになりにくい貴ガス元素がきて、その次に陽イオンになりやすいアルカリ金属がくるという配置になり、周期表はより理解しやすいものになりました。
1913年、デンマーク人理論物理学者ニールス・ボーア(1885~1962年)が提唱したボーアの原子模型で、元素は電子配置によって性質が左右され、その軌道が周期表の周期と対応しており、元素の性質を示す構造が理論的に説明されました。
1959年、アメリカ人量子化学者ライナス・ボーリング(1901~1994年)が同位体の存在を考慮し、「元素とは、原子核の陽子数で分けた原子の種類のことである」と「一般化学」という教科書で定義し、化学者のあいだで公知となりました。
現在の周期表では、元素は原子量の順ではなく、原子番号(原子核の中の陽子の数)の順に並べられています。現在のところ元素は118種類が確認されています。
無機化学における構造論の起源となるのは、遷移元素錯体の八面体形の構造を提唱して「錯体化学の創始者」と呼ばれるスイス人化学者アルフレート・ヴェルナー(1866~1919年)が発表した、金属錯体のd軌道の分裂を、「金属のd軌道が配位子の軌道と相互作用することにより、エネルギーの低い軌道と高い軌道に分裂するためにd軌道の分裂が起こる」と説明した配位子場理論でした。しかし、d軌道の分裂の大きさを定量的に示すには問題がありました。
19世紀の終わりまでには、物質は、原子と呼ばれる粒子が集まってできているとする原子論が確立していました。19世紀後半以降、ドイツ人理論物理学者アルベルト・アインシュタイン(1879~1955年)やフランス人理論物理学者ルイ・ド・ブロイ(1892~1987年)らをはじめとする多くの研究によって、光や電子のような素粒子だけでなく、原子や分子などの複合粒子も、粒子のような性質と波動のような性質を併せ持つと結論付けられました。
原子に属する電子の挙動は、その波動に係わる物理量の振動を空間座標と時間の関数として表した「波動関数」で表されます。電子は波動関数で表される軌道に入っています。d軌道は、原子を構成している電子軌道の1種です。
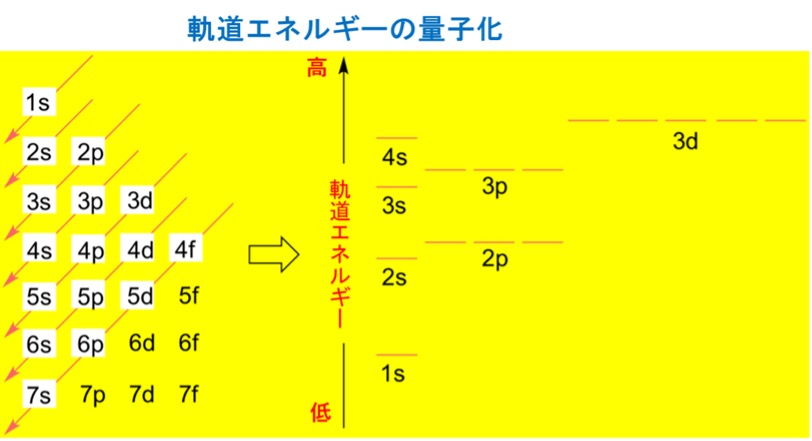
軌道には、軌道エネルギーというエネルギーが付随しており、軌道エネルギーは波動関数で量子化され、「1s<2s<2p<3s<3p<3d・・・」の順にトビトビに高くなります。電子はエネルギーの低い軌道から順に2個ずつ入っていきますが、軌道には定員が決まっており、1つの軌道に2個以上の電子が入ることはできません。
1893年、ヴェルナーは「中心に遷移金属原子があり、その周りに中性または陰イオンの配位子がある」という錯イオンを含む配位化合物の正しい構造を提唱しました。また、互いに大きさが等しく正負が逆の光学活性を示す「光学異性体」の錯体の存在も予測して、結合の組み換えなしには分子をそれ自身の鏡像に重ね合わせることができないという性質を持つ「キラル化合物」の合成に成功しました。
その後は金属錯体を中心に無機化学は展開し、金属錯体を研究する「錯体化学」において無機構造化学が確立されました。錯体化学は構造論を軸としているので、対象化合物の構造解析が重要です。
遷移金属は周期表で第3族元素から第12族元素の間に存在する元素の総称ですが、第12族元素(亜鉛族元素、亜鉛[Zn]、カドミウム[Cd]、水銀[Hg])は、化学的性質が周期表の1族、2族と12族から18族の元素で、全ての非金属と一部の金属から構成される典型元素に似ており、また、イオン化してもd軌道が10電子で満たされて閉殻していることから、典型元素に分類され、遷移元素に含まれないこともあります。
遷移元素の単体は一般に高い融点と硬さを有する金属で、常磁性を示すものも多く、鉄[Fe]、コバルト[Co]、ニッケル[Ni]のように強磁性を示すものも存在します。また、化合物や水和イオンが色を呈するものが多く、種々の配位子と錯体を形成できるほか、触媒として有用なものも多くあります。
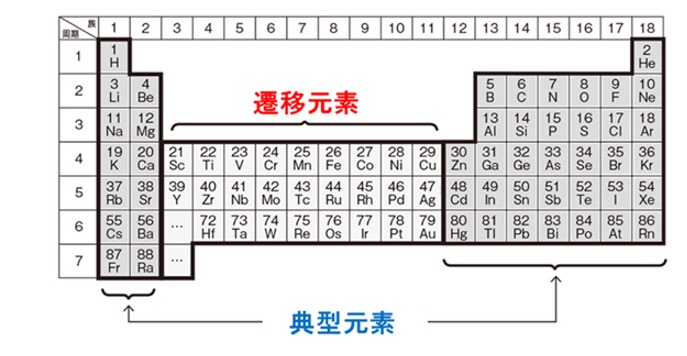
遷移金属錯体では、配位構造変化により、分子または錯体が中心となる原子に結合することで形成される幾何学的なパターンに伴う光の吸収スペクトル変化が顕著なので、多くは「紫外可視近赤外分光法(UV-Vis-NIR)」で構造解析されます。
20世紀後半に入ると、光の代わりに電子線をあてて拡大する「電子顕微鏡」や、X線が結晶格子で回折を示す現象を利用して物質の結晶構造を調べる「X線構造解析」などによって、サブミクロンサイズの物理計測が可能になったことで、より直接的な構造解析が行われるようになりました。
さらに、必要に応じては、測定対象の物質に赤外線を照射し、透過光または反射光を分光することでスペクトルを得て、対象物の特性を知る「赤外分光法(IR)」や、外部静磁場に置かれた原子核が固有の周波数の電磁波と相互作用する現象によるスペクトルを得て、対象物の特性を知る「核磁気共鳴分光法(NMR)」、また、磁場中に置かれた原子の不対電子が,特定の周波数の電磁波(マイクロ波)を吸収して,エネルギーの低いスピン状態からエネルギーの高いスピン状態に移り変わることで、分子中の電子構造が解析できる「電子スピン共鳴(ESR)」なども利用されています。
このため、構造論は飛躍的な発展を見せています。
超電導とは、電気伝導性物質(金属や化合物など)が、低温度下で、電気抵抗が「0」へ転移する現象・状態を指します。この転移温度を超伝導転移温度と呼び、超伝導転移温度が室温程度の物質を得ること(室温超伝導)は、材料科学の重要な研究目標の一つです。
今日の無機化学においては、転移温度が液体窒素温度「-195.8℃、77K」以上で転移する高温超伝導物質のペロブスカイト相などの構造論を中心とした研究が主流となっています。
ペロブスカイト相とは、 灰チタン石(ペロブスカイト)と同じ結晶構造です。下図に示したペロブスカイト構造図のように、立方晶系の単位格子をもち、立方晶の各頂点に金属「R」が、体心に金属「M」がそれぞれ位置し、金属[M]を中心として酸素[O]が立方晶の各面心に位置する結晶構造をもちます。
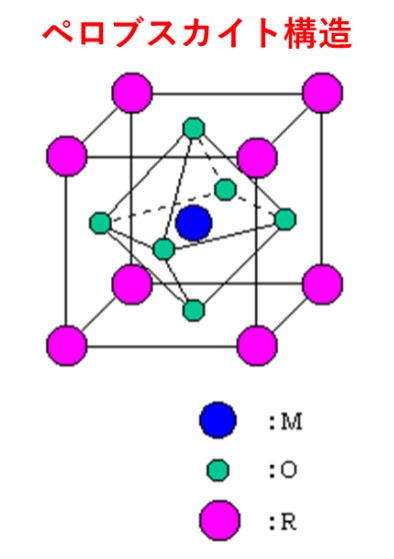
チタン酸バリウム 「BaTiO3」 など、RMO3 の3元系から成る遷移金属酸化物が、この結晶構造をとり、ペロブスカイト太陽電池や、白金族金属元素をペロブスカイト型酸化物に吸着させて回収リサイクルする研究開発が進んでいます。
しかし、1951年の「 Fe(C5H5)2」の化学式 で表される鉄のシクロペンタジエニル錯体であるフェロセンの発見に端を発して、シクロペンタジエニルアニオン(C5H5-)2個を配位子として有する有機金属化合物のメタロセン、パイ錯体など従来の配位理論の範疇を超える錯体の発見へとつながり、シクロペンタジエニル錯体の構造論と反応性との研究成果は有機金属化学における新しい触媒や新しい反応試剤の開発へとつながり、有機合成化学とも深いつながりをもたらすようになりました。やはり、有機化学と無機化学の境界線は消えたまま現在に至っているようです。
たとえ、錯体が有機金属化合物であっても、無機化合物に分類される炭素以外の配位子をもつ錯体であっても、扱う物質の領域が有機化学と無機化学にまたがっているので、新しい時代の化学は、有機化学と無機化学の境界線をはずすことからスタートするでしょう。
文献:
ウィキペディア・フリー百科事典
「無機化学」「Nicolas Lemery」「アントワーヌ・ラボアジェ」「イェンス・ベルセリウス」
「フリードリヒ・ヴェーラー」「周期律」「周期表」「ヨハン・デーベライナー」「アレッサンドロ・ボルタ」
「ウィリアム・ウォラストン」「ドミトリー・メンデレーエフ」「ニールス・ボーア」
「ライナス・ボーリング」「アルフレート・ヴェルナー」「配位子場理論」「光学異性体」「キラリティー」
「遷移遷元素」「典型元素」「紫外可視近赤外分光法」「電子顕微鏡」「X線構造解析」「赤外分光法」
「核磁気共鳴法」「電子スピン共鳴」「高温超伝導物質」「ペロブスカイト構造」「フェロセン」「メタロセン」
2024年2月1日
「化学の泉」投稿文(その25)/豆知識(はじまりシリーズ)
【医薬品の歴史】
石器時代のころから現代に至るまで、食物の確保と病気の克服は、人類にとっての最重要な問題として取り組まれてきました。
太古の人たちは口にした自然物、ことに草根木皮がときに毒となって有害な作用をあらわし、ときにその毒が病気の苦しみを緩和しさらに治療する薬になりうることを知り、多くの経験を積み重ねて、食と毒と薬の区別と利用知識を習得するに至りました。このように食をめぐる経験、知識の蓄積と進歩は、同時にある特定の病気に効果のある食物など、病気の治療に有効な天然薬物、その時可能な医療処置の発見など、その後の進歩をもたらし、伝承されてきたと考えられます。
陸上の植物は名前がつけられているもので25万種ほど。このうち、私たちが食べても平気なものは数%程度といわれています。私たちの祖先は、果実、葉や花をかじり、時には食べてみました。こうした試行錯誤を繰り返してきたのでしょう。多くはしびれたり、嘔吐したり、下手をすると死んでしまったと思われます。おそらく、食べられるものは20種に1種程度だったでしょう。
それでも、祖先たちは徐々に食べられる植物を見つけ、さらに驚くことには薬草を見つけました。古代の治療師は、どれが薬草か、その薬草をどう使えばいいのかを見極めていました。
紀元前4000年頃、メソポタミア文明を築いたシュメール人たちが残した粘土板には、すでに数多くの植物の名前が薬用として記載されていました。
「医学の父」と言われる古代ギリシアの医者ヒポクラテス(紀元前460年頃~紀元前370年頃)は、医学を原始的な迷信や呪術から切り離し、臨床と観察を重んじる経験科学へと発展させました。彼の薬草治療は、病気は体液のバランスの乱れから生じると考える「体液病理説」により、267種類の薬草を用いた記録が残っています。
1世紀には、ローマ皇帝ネロの治世下の古代ローマで活動した、「薬草学の父」といわれる古代ギリシアの医師で薬物学者のペダニウス・ディオスコリデス(40年頃~90年)が、系統的かつ科学的に薬物について記された世界最初の薬学誌「デ・マテリア・メディカ」をまとめました。ディオスコリデスはローマ皇帝ネロの侍医であったとも伝えられ、軍隊とともに各地を転戦するあいだに、自ら採取した何百種類もの薬草の用途や効果を一覧するだけではなく、薬の作成方法や推薦用量も記載していました。葉ならば乾燥して砕き、弱火で煎じ、根は洗ってから叩いてペースト状にしたり、生で食べたりします。ワインと混ぜたり、水と混ぜたりもしました。丸薬や水薬として飲んだり、吸入したり、肌にすり込んだり、座薬として挿入されるモノもありました。「デ・マテリア・メディカ」は、以後およそ1500年にわたりラテン語やアラビア語などに訳されて中世・近世の中近東およびヨーロッパに薬の手引き書として大きな影響を与えました。
古代から17世紀までの2千年近くもの間、栄えた錬金術は、紀元後間もない頃に、エジプトのアレクサンドリア、南米、中米、中国、インドで行われていました。いずれの地域でも金属から金を得たいという欲望、病気の治療などが動機になっていました。
錬金術師たちは、「『賢者の石』という物質を使えば、金属を金に変えられる」と信じて、賢者の石を作り出すために分別を失うほど熱中しました。この石には鉱物の元素も、金属の元素も、霊的な元素も入り込んでいるので、あらゆる生物の病気を治し、健康を維持する万能薬とも考えられ、不老不死の薬とも考えられていました。
錬金術は薬の製造にも使われました。なかでも活躍がめざましかったのがスイス人の医師で錬金術師のパラケルスス(1493年~1541年)です。本名はテオフラストゥス・フォン・ホーエンハイムでした。本名の代わりに名乗ったパラケルススというのは「ケルススに勝てる」という意味でした。当時再発見された、1世紀の古代ローマの医師アウルス・コルネリウス・ケルスス(紀元前25年頃~紀元後50年頃)の著書が医学界で大流行していました。パラケルススは、ケルススの著書の大部分が紀元前4世紀に亡くなったヒポクラテスの著書の焼き直しであることを見抜いて、それならば、自分は彼より優れているとして「ケルススに勝てる」と名乗ったと考えられます。論争好きで挑発的で、世間の評判が相反するパラケススは、「錬金術を医学に役立つように利用して、化学的な治療法の開発や、それぞれの病気の治療に合う薬を調合すべきである」と考え、自分の実力を証明しようと、当時の医学の権威にたてつきました。彼は治療薬や器具が入ったカバンを携えてヨーロッパ中を旅しました。彼は「あらゆる金属は水銀と硫黄からつくられる」という錬金術の従来の考え方を批判し、水銀と硫黄の他に第3成分として塩を加えました。この三原質説は、それまでの水銀・硫黄説に取って代わりました。それまで、ヨーロッパの薬の大部分は植物を原料にしていましたが、パラケススは鉱物の薬も加えて、酸化鉄や水銀、アンチモン、鉛、銅、ヒ素などの金属の化合物をはじめて医薬品として使用しました。現在でも、パラケススが治療に使った化合物は、皮膚病の薬のほか、様々な用途に使われています。
「薬草」から「合成医薬品」への時代の流れは、19世紀の初めに、天然物化学の発展によりハーブから活性成分の単離や合成が進み、1805年にはアヘンからモルヒネ、1860年にはコカの葉からコカインが単離され、1897年にはアスピリンが合成されました。また1928年には「ペニシリン」が発見され抗生物質の時代がはじまりました。
19世紀後半には次々と細菌が発見され、「特定病因論(特定の病気は特定の菌によってもたらされるという考え)」が世の中に定着しました。
医療のために植物全体を使うのではなく、植物から化学物質を取り出して利用する方法が進み、やがて化学物質を合成する研究も進み、医薬品といえば製薬会社が作るのが一般的になりました。
「薬草」は「化学合成医薬品」に医薬品の座を受け渡すこととなり、植物療法は徐々に衰退していきました。
1847年にドイツ人有機化学者アウグスト・ケクレ(1829~1896年)によって、ベンゼンの構造が解明されました。19世紀の半ばにドイツ人化学者アウグスト・ヴェルヘルム・フォン・ホフマン(1818~1892年)が、臭くてネバネバして使い道がないコールタールからアニリンを抽出することに成功しました。そして、1856年にはホフマンの助手をしていたイギリス人化学者ウィリアム・パーキン(1838~1907年)が、アニリンを二クロム酸カリウムで酸化して世界初の紫色合成染料「モーブ」を作りました。
ベンゼンの構造が明らかになり、コールタールからベンゼン(C6H6)を取り出してアニリン(C6H5NH2)をつくると、ベンゼンを出発点にどうしたらアニリンを合成できるのかという「分子の設計図」を描くことができるようになりました。
その後、分子構造を基にした「分子設計図」からアカネの赤色合成染料「アリザリン」や藍色合成染料「インディゴ」が合成されるようになり、合成染料が染料工業の主流となりました。
1890年代後半には、ドイツに数多くの染料メーカーがあり、競争も激しく市場も飽和しつつありました。バイエル社(1863年創業)は、合成アリザリン市場に参入していましたが、合成染料の収益で医薬品開発への転換を図っていました。1897年に自社のドイツ人化学者フェリックス・ホフマン(1868年~1946年)がヤナギの樹脂から分離されるサルチル酸[HOC6H4COOH]のヒドロキシ基[-OH]の[H]をアセチル基[CH3CO-]で置換してアセチルサリチル酸[C6H4(COOH)OCOCH3]を合成しました。
もともとサリチル酸には解熱鎮痛作用と炎症を抑える作用がありましたが、胃の粘膜を激しく痛めるので医薬品としての価値は低かったのですが、アセチルサリチル酸はサリチル酸の炎症を抑える作用を維持したまま、胃への障害が無くなったので、1899年、バイエル社はこの粉末を小さな包みに入れて「アスピリン」として販売しました。
バイエル社でアスピリンが販売された頃、ドイツ人の細菌学者で生化学者のパウル・エールリヒ(1854年~1915年)は、染料から医薬品が作れないかと試みました。彼は、一部の染料がヒトの細胞より細菌にくっつくことから、細菌にとって有害な染料でありながらも、それ以外のヒトの組織には害がない染料を作れるかもしれないと考え、何年もかけて、何百もの化合物を作っては試験を繰り返し、失敗に次ぐ失敗の後、1909年に、弟子であった日本人の細菌学者 秦 佐八郎(はた さはちろう;1873年~1938年)が発見した「サルバルサン(ヒ素化合物製剤606号)」が、当時難病であった梅毒スピロヘータに有効であることが明らかになり、1910年にエールリヒの研究に協力していたドイツの染料会社のヘキスト社が「サルバルサン」という名前で販売しました。サルバルサンはヒ素を含んでおりいくつかの副作用がありましたが、当時主流であった、水銀蒸気を吸引して、もし生き残っても、大半が無機水銀中毒になった水銀療法の残酷さよりマシでした。梅毒の発症者を減らしたこの薬はヘキスト社に大きな利益をもたらし、他の医薬品に手を伸ばすための資金になりました。
1918年、ドイツ共和国が連合国に降伏して、第一次世界大戦が終結しました。ドイツ経済もドイツ化学業界も苦境に陥り、1925年に、経済状況が悪いなか、化学産業を振興させるために、主要な化学会社を合弁して、「IG・ファルベンインドゥストリー」と呼ばれる世界最大の巨大化学企業連合体を作りました。
IG・ファルベンインドゥストリーの化学者は、いつも新しい物質の開発を目標にしていました。そして、その多くはコールタールからつくられた合成染料の類似化合物でした。医師の指導の下に、化学者のチームが数多くの物質を試験し、有望な手がかりがあれば、原子をくっつけたり取り去ったり、分子を入れ替えたりして新たな類似化合物を作り、効果のある薬を探し求めました。
そんな中、1932年に、ドイツ人医師ゲルハルト・ドーマク(1895年~1964年)は、真っ赤なアゾ染料「プロントジル」が溶連菌(溶血性レンサ球菌)に著しく効果を発揮することを発見しました。ドーマクは、第一次世界大戦に従軍して、戦場で傷口から侵入した細菌によって命を落とす多くの兵士を見ていました。その多くは溶連菌によるものでした。ドーマクは毒性が強いレンサ球菌を単離して、その細菌を感染させたマウスに、化学者チームが合成した物質を投与し、その効果を次々と判定していました。何万匹のマウスが死んでいった中、ついにプロントジルを投与された感染マウスが完全に回復したことを確認しました。
当初は、染料が持つ抗菌活性が細菌をやっつけたのだと考えられていましたが、フランスの化学者が、プロントジルが体内で分解して生じる「スルファニルアミド」が抗菌活性を持つことを発見すると、化学者たちは類似化合物を合成し始め、1935年から1946年にかけて5000以上ものスルファニルアミド誘導体がつくられました。これらはサルファ剤と総称され、抜群の効果を発揮して、数多くの人命を救いました。
しかし、サルファ剤を広く受け入れていたアメリカで、甘い水薬として飲みやすくしたサルファ剤による死亡事故が相次ぎ、薬禍事件となりました。発足直後の連邦政府の小さな組織だったFDA(アメリカ食品医薬品局)とアメリカ医師会が調査を行い、この水薬にサルファ剤を溶かすために、甘味があり有毒なジエチレングリコールが使われていることが突き止められました。それまでも野放し状態の危険な医薬品を規制しようという動きはありましたが、医薬品関係業界からの献金や広告を得ていた政治家やメディアの規制への反対があり、医薬品規制法が成立しませんでしたが、この薬禍事件をきっかけに1938年、連邦食品・医薬品・化粧品法が可決されました。そして、このFDAの権限を強化し、新しい薬に対して、市販前に安全であることを証明し、活性成分をすべてパッケージや添付文書に記載することを要求したアメリカ最初の法律は、現在も医薬品法の根幹をなしており、世界中の国々の法律のモデルになっています。
サリファ剤は耐性菌ができやすく、またその後抗生物質やその他のもっと優れた抗菌薬が登場したことで、現在はほとんど使用されていません。
「抗生物質」は、微生物によってつくられた微生物や細菌の生育を阻止する物質です。1928年、イギリス人細菌学者アレクサンダー・フレミング(1881年~1955年)は、最初に人体に応用された抗生物質の「ペニシリン」を発見しました。フレミングは偶然に混入したアオカビが、黄色ブドウ球菌の発育を抑える抗生物質を出していることを発見し、「ペニシリン」と名付けましたが、発見当時はあまり注目されませんでした。
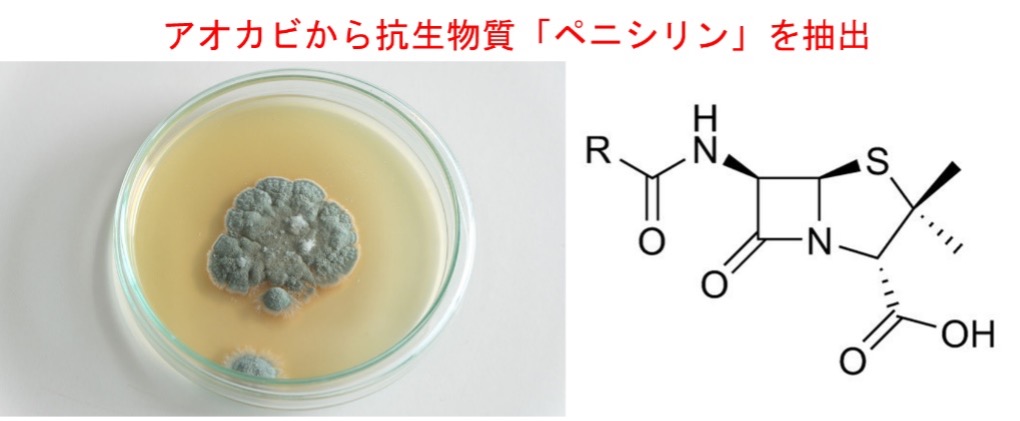
第二次世界大戦の激化で傷病兵が増加したころ、オーストラリア人生理学者ハワード・フローリー(1898年~1968年)やドイツ生まれのイギリス人生化学者エルンスト・ポリス・チェイン(1906年~1979年)らによって、ペニシリンの研究が再開され、1940年には培養液からペニシリンが抽出され、部分精製に成功し、その後、大量生産も可能になり、大戦の多くの傷病兵の命を救いました。
1950年代にペニシリンの分子構造が明らかになると、天然のペニシリンを化学的に部分変化させた半合成ペニシリンが登場しました。現在は化学構造の違いによって、色々なペニシリンがあり、肺炎をはじめ多くの化膿性の疾病のほか、敗血症、産褥(さんじょく)熱、梅毒などに著しい効果を示しています。
ペニシリンの成功で、化学者や微生物学者を感染症に有効な物質探しに駆り立てたなか、1944年に、ウクライナ出身ユダヤ人の生化学者で微生物学者のセルマン・ワクスマン(1888年~1973年)が土壌の中で結核菌が死ぬことからヒントを得て、放線菌の培養液から、結核菌に効果を示す「ストレプトマイシン」を抽出しました。その後、放線菌からは、「テトラサイクリン」や「クロラムフェニコール」などの多くの抗生物質が見つかりました。
しかし、色々な疾病の治療薬として抗生物質を多用したために、細菌は素早く逆襲を開始し、抗生物質の効かない「耐性菌」が出現しました。「メチシリン」は耐性菌に強い抗生物質として登場しましたが、これさえも効かない、院内感染などで現在最も問題になっている「メチシリン耐性黄色ブドウ球菌(MRSA)」が出現しています。
耐性菌のできにくい新しい抗菌薬の開発が進んでいますが、今でも、病原菌との果てしない闘いが続けられています。
文献:
ウィキペディア・フリー百科事典
「医薬品」「医薬品化学」「薬学史」「薬草」「ヒポクラテス」「四体液説」「ペダニウス・ディオスコリデス」
「パラケルスス」「アウルス・コルネリウス・ケルスス」「アウグスト・ケレク」
「アウグスト・ヴェルヘルム・フォン・ホフマン」「ウィリアム・パーキン」「アリザリン」「インディゴ」
「バイエル (企業)」「フェリックス・ホフマン」「サルチル酸」「アセチルサリチル酸」
「パウル・エールリヒ」「秦 佐八郎」「サルバルサン」「IG・ファルベンインドゥストリー」
「ゲルハルト・ドーマク」「プロントジル」「スルファニルアミド」「サルファ薬」「ジエチレングリコール」
「連邦食品・医薬品・化粧品法」「抗生物質」「アレクサンダー・フレミング」「ペニシリン」
「ハワード・フローリー」「エルンスト・ポリス・チェイン」「セルマン・ワクスマン」「放線菌」
「ストレプトマイシン」「テトラサイクリン」「クロラムフェニコール」
「メチシリン耐性黄色ブドウ球菌」
2024年1月1日
「化学の泉」投稿文(その24)/豆知識(はじまりシリーズ)
【有機化学の歴史】
有機化合物とは、炭素原子が共有結合で結びついた骨格を持った、炭素を含む大部分の化合物をさします。有機化合物を構成する主な元素は、C,H,O,Nと元素の種類は限られますが、炭素の原子価は「4価」で、さまざまな構造を取れるため、たくさんの種類の有機化合物が存在します。
しかし、歴史的背景から、炭素を含む化合物であっても一酸化炭素[CO]、二酸化炭素[CO2]、青酸[HCN]、炭酸塩、シアン酸塩、チオシアン酸塩などの単純なものは例外的に有機化合物ではなく無機物質として扱われます。
砂糖、デンプン、タンパク質、酢酸、アルコールなど、多くの物質が有機物です。それに対し、無機物は、水や岩石や金属のように生物の働きを借りないで作り出された物質です。
18世紀になると、生物の体を形づくる物質を「有機物」、そうでない物質を「無機物」と区別しました。有機物の「有機」とは、「生きている、生活をする働きがある」という意味です。生物のことを「有機体」と言います。つまり、有機体という生命力を持つ生物が作る物質が「有機物」です。
近代化学の父と呼ばれるフランス人の化学者アントワーヌ・ラボアジェ(1743~1794年)の時代の化学者達は、生物すなわち有機体に由来する化合物には生命力が宿っているため特別な性質を持つとみなしていました。
その時代は水銀や酸素など無機物が主役であり、有機物と言えばオリーブ油や砂糖などの生物体から産出される特別な物質に限られていました。これらは加熱すると容易に煙を出して焦げ付いてしまうので、無機物のように強く燃焼させてその酸化物を研究することは極めて困難で、有機物は不明のまま取り残されていました。長い間、有機物は生命の働きで作り出されているもので人工的につくることは不可能である、と考えられてきました。
初めて「有機物」という名称を提唱したのは、近代化学の理論体系を組織化して集大成したスウェーデン人の化学者で医師のイェンス・ベルセリウス(1779~1848年)でした。ベルセリウスによる有機物との名称は、17世紀から18世紀のドイツ人の化学者で医師のゲオルク・エルンスト・シュタール(1659~1734年)が主張した、有機体(生物)の体内でしか製造できない化合物という生気論の概念を言語化したものでした。ベルセリウスは物質を生物から得られるものと鉱物から得られるものとに分け、それぞれ「有機化合物」「無機化合物」と定義しました。この通念は、19世紀はじめまで化学の世界を支配していました。有機物は特別な物質だったのです。
ところが1828年、「有機物」の提唱者ベルセリウスの弟子であり、「有機化学の父」と呼ばれるドイツ人の化学者フリードリヒ・ヴェーラー(1800~1882年)が、無機物であるシアン酸アンモニウム[NH4OCN]から有機物である尿素[(NH2)2CO]を人工的に作り出すことに成功しました。ヴェーラーは、スウェーデンのベルセリウスの元に留学しており、このときドイツに帰国したばかりでした。彼はベルセリウスに手紙を出して、「先生、私は動物の腎臓の力を借りずに、尿素を作りました」と、この発見を知らせました。実際には、尿素は腎臓ではなく肝臓で作られるのですが、それはともかくとして生物の生命力を借りずに無機物から有機物を合成したことが画期的であり、その事実は、当時の化学者たちに衝撃を与えました。シアン酸アンモニウムはアンモニアとシアン酸に化学分解し、求核付加反応(化合物に求核剤[主に炭素へ反応し、結合を作る化学種]が付加することによってπ結合が解裂し、新たに2つの共有結合が生成する反応)を起こして尿素になります。
[NH4OCN⇒NH3+HOCN⇔(NH2)2CO]
シュタールの生気論、「有機物は、有機体(生物)の体内でしか製造できない化合物」という定義は意義を失いましたが、以降有機化合物を扱う有機化学は飛躍的な発展を遂げることになりました。
この尿素の合成に端を発し、有機物は生物に必ずしも付属したものに限定されないと考えられるようになり、この発見以降、複数種類の有機化合物が生物の関与なしに化学的に合成されるに至り、生気論に対する打撃となりました。
有機物という語は現在でも用いられていますが、「生物由来」という概念を持っていたベルセリウスによる有機物の名称とは意味が変化してきました。すなわち、現在の「炭素原子が共有結合で結びついた骨格を持った炭素を含む大部分の化合物」という有機化合物の定義と、ベルセリウスによる「生物から得られるもの」という区分は厳密にいうならば完全には一致していません。そして実際にも、生物を介さず化学的に合成された多数の化合物が有機化合物の物質群に含まれています。現在では、「生物由来の有機化合物」という意味で、「天然物」あるいは「天然化合物」という用語が使用されることもあります。
ドイツ人の化学者ユストゥス・フォン・リービッヒ(1803~1873年)は、有機化学の確立に大きく貢献した19世紀最大の化学者の一人です。クロロホルム、クロラール、アルデヒドなどをはじめ多くの有機化合物を発見し、応用化学においては、植物は窒素・リン酸・カリウムの3要素が必須であるとし、「植物の生長速度や収量は、必要とされる栄養素のうち、与えられた量のもっとも少ないものにのみ影響される」とする、リービッヒの最小律を提唱して、化学肥料を作り、「農芸化学の父」とも称されました。
1847年、ベンゼンの構造式として二重結合と単結合が交互に並んで六員環を構成するケクレ構造(亀の甲)を提唱した、ドイツ人の有機化学者アウグスト・ケクレ(1829~1896年)はドイツのギーセン大学の建築学科に入学しましたが、リービッヒの有機化学の講義を聴講して感銘を受け、一旦退学し有機化学へと転向しました。
1858年、研究に励んだケクレは「炭素は4つの結合手を持つ原子(原子価4)であり、炭素原子どうしや他の原子と結びつく」という説を発表しました。つまり、炭素の原子価は4、水素の原子価は1なので、炭素原子1個が4本の結合手、水素原子1個が1本の結合手を持っていることを意味します。
たとえば、メタン[CH4]は4本の結合手を持った炭素原子を中心に、炭素原子の1本ずつの結合手と4個の水素原子がそれぞれ1本ずつの結合手で結びついているイメージです。エタン[C2H6]は2個の炭素原子が1本ずつの結合手で結びつき、それぞれの炭素原子の残り3本の結合手が水素原子の結合手と結びついているイメージです。エチレン[C2H4]は2個の炭素原子が2本ずつ結合手で結びつき、それぞれの炭素原子の残り2本の結合手が水素原子の結合手と結びついているイメージです。従って、エタンの炭素原子どうしの結合は単結合で、エチレンの炭素原子どうしの結合は2重結合であることがイメージできます。
当時は、ベンゼン[C6H6]の構造がどうなっているかは謎でしたが、この謎は1865年にケクレによって解かれました。ある日、ケクレは、蛇が自分の尾をくわえて輪になっている夢を見て、ベンゼンの6個の炭素が輪になるという着想を得ました。ケクレは、ベンゼンの構造を、6個の炭素原子が正六角形に並び、二重結合と単結合が1つおきに存在しているように、その骨格構造を図式化しました。建築学科で学んでいたケクレには、有機物の炭素骨格の構造を視覚化する能力が備わっていたのかもしれません。建築学から化学へ。他人からすると遠回りをしているように見えても、経験というものは意外なところで役に立つものなのでしょう。
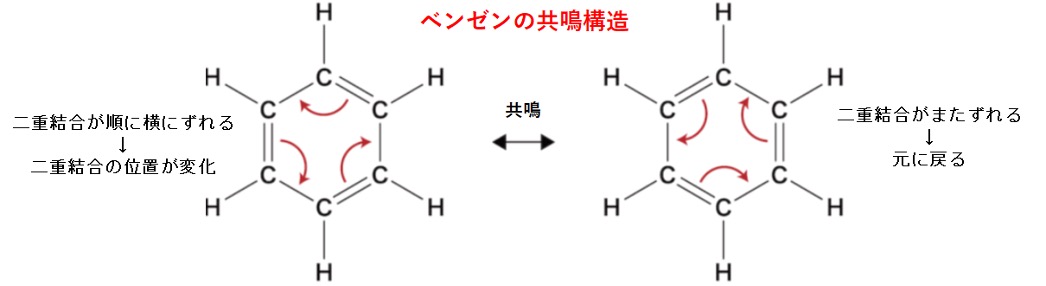
その後、有機物の構造などが次第に明らかにされました。ベンゼンは二重結合と単結合が絶えず入れ替わり、炭素と炭素間の結合は、ある瞬間は二重結合で、また、ある瞬間は単結合になります。さらに、各結合が二重結合と単結合の中間的な性質の一.五重結合的な様子になっているという「共鳴結合」が提唱されました。この様に、ケクレによるベンゼンの構造の解明によって、有機物の合成に理論的な見通しが立つようになりました。
炭化水素にはベンゼン環をもたないメタン、エタン、エチレン、などの鎖式炭化水素や、ベンゼン環をもたないが炭素が環状に結びついている環式炭化水素もあります。
芳香族炭化水素は、「ベンゼン環が安定しており、ベンゼン環を保持したまま、炭素原子にくっついている水素原子が他の原子や原子団と置き換わる反応を受ける」という特徴があります。
例えば、19世紀の半ばに、英国王立化学学校の教授でドイツ人化学者アウグスト・ヴェルヘルム・フォン・ホフマン(1818~1892年)が、臭くてネバネバして使い道がないコールタールからアニリンを抽出することに成功しましたが、1856年に、ホフマンのもとで助手を務めていたイギリス人化学者ウィリアム・パーキン(1838~1907年)は、マラリアの特効薬であるキニーネの合成に取り組み、キニーネを分解するとアニリンによく似た物質が出来ることから、逆にアニリンからキニーネを合成出来ないかと試しているうちに、偶然にもアニリンを二クロム酸カリウムで酸化して、世界初の紫色合成染料「モーブ」を作りました。
コールタールからベンゼン[C6H6]を取り出してアニリン[C6H5NH2]をつくり、ベンゼンの構造が明らかになると、ベンゼンとアニリンの違いがわかります。アニリンは、ベンゼンの水素原子[-H]の一つをアミノ基[-NH2]で置き換えたものです。このことから、ベンゼンを出発点にどうしたらアニリンを合成できるのかという「分子の設計図」を描くことができるようになりました。
分子構造を基にした「分子設計図」から合成した染料が、アカネの赤色合成染料「アリザリン」です。1868年、ドイツのカール・グレーベ(1841~1927年)とカール・リーバーマン(1842~1914年)は、「アリザリン」の分子構造を決定して、コールタールの成分「アントラセン」から「アリザリン」の合成に成功しました。合成染料「アリザリン」の登場から数年後には、フランスのアカネ畑の多くは休耕になり、ブドウ園に変わっていきました。その原因は、合成染料「アリザリン」の値段は天然物と比較して半分以下だったので、アカネの市場価格が大きく下落したためでした。
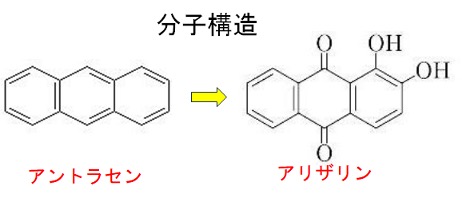
ドイツ人のアドルフ・フォン・バイヤー(1835~1917年)は、インディゴの分子構造を決定する研究を基に、1880年に桂皮酸から藍色合成染料「インディゴ」の合成に成功しました。藍の染料インディゴは「染料の帝王」と呼ばれ、インドの特産として多量にヨーロッパへ輸出されていました。しかし、合成染料「インディゴ」が市場に出回ると、数百年来独占されていたインドを中心とする全世界の藍栽培と天然藍染工場は破産に追い込まれました。
これらの合成染料は、石炭の乾留成分コールタールからつくられました。汚くて臭い液体で、捨てるほかなかったコールタールが、貴重な原料としてよみがえりました。1862年、ロンドンで開かれた万国博覧会では、鮮やかな色合いの合成染料が、汚らしいコールタールと対照をなして展示されました。
その後に登場したナイロンなどの合成繊維を染めるのに適していたために、世界は合成染料が染料工業の主流となりました。
1860年代以降、世界の染料工業を先導したのはドイツでした。ドイツの化学工業は3つの会社を軸に発展しました。1つはバーデン・アニリン&ソーダ製造所(BASF社、1865年創業)です。アリザリンを合成したグレーベとリーバーマンの二人と契約して、アリザリンの商業生産を開始しました。2つ目は、ヘキスト社(1863年創業)です。鮮やかな赤色染料アニリンレッド(マゼンダ)の独自の合成法で特許を取ったアリザリン、合成インディゴを生産しました。3つ目は、バイエル社(1863年創業)で、合成アリザリン市場に参入しました。1860年代、合成染料の全世界の生産量のこの3社で占める割合はわずかでしたが、1881年には半分を占めるようになりました。1900年頃には、ドイツの企業が全世界の染料市場の90%を占めました。
バイエル社は、合成染料の収益で医薬品の開発・生産に乗り出し、1900年頃にはアスピリンを販売しました。第一次・第二次世界大戦の中で、この3社を含む多数の化学企業が合同して「IG・ファルベンインドゥストリー」と呼ばれる世界最大の巨大化学企業のトラストを結成しましたが、第二次世界大戦後に解体され、現在では、プラスチック、合成繊維、医薬品など有機化学業界で大きな存在感を示しています。
20世紀に入ると有機化合物の構造と物性との関連について理解が進み、分子構造を改変することで物質の機能をデザインするということがおぼろげながらも可能になってきました。最初は染料の分野で始まったこの流れは、医薬あるいは繊維の分野に波及し化学工業という産業分野が勃興しました。
1950年代以前は石炭ガスの副産物であるコールタールが化学工業の主要資源でしたが、1950年代以降に急速に発展した石油化学工業が石油に由来する多量でかつ多様な有機化合物原料を提供するようになりました。それにより高分子化学製品である様々なプラスチックを始めとして、衣・食・住など人間生活の様々な局面に、機能を設計された多種多様な有機化合物が活用されるようになりました。
しかし、有機化合物は生命体の構成分子との類似性が高く自然界に開放されると生命に吸収されるなど、金属などの無機物よりも比較的毒性が強く、現在では、環境の側面での影響が大きいために、様々な対策が行われています。
文献:
ウィキペディア・フリー百科事典
「有機物」「有機化合物」「アントワーヌ・ラボアジェ」「イェンス・ベルセリウス」
「生気論」「ユストゥス・フォン・リービッヒ」「フリードリヒ・ヴェーラー」「ヴェーラー合成」
「求核付加反応」「アウグスト・ケクレ」「共鳴結合」
「アウグスト・ヴェルヘルム・フォン・ホフマン」「ウィリアム・パーキン」「アニリン」
「カール・グレーベ」「カール・リーバーマン」「アントラセン」「アリザリン」
「アドルフ・フォン・バイヤー」「インディゴ」「BASF」「ヘキスト」「バイエル」
2023年12月4日
「化学の泉」投稿文(その23)/豆知識(はじまりシリーズ)
【農薬の歴史】
農薬とは、農業の効率化、または農作物の保存に使用される薬剤の総称です。殺菌剤、防黴剤(ぼうばいざい)、殺虫剤、除草剤、殺鼠剤(さっそざい)、植物成長調整剤(植物ホルモン剤など)等を農薬と言います。
農薬は、元々は土壌や種子の消毒と、発芽から結実までの害虫や病気の予防をする薬剤を指していましたが、農作物の虫害や植物の成長調整など、「農業の生産性を高めるために使用される薬剤」として広義に解釈されるようになりました。 近代化された農業では、農薬が大量に使用されています。一方、人体に影響をもたらす農薬も多くあることから、使用できる物質や量は法律等で制限されています。
紀元前から、ユリ科の越年草で薬用植物の海葱(かいそう;有毒アルカロイド配糖体であるステロイド配糖体を含む)を利用したネズミ駆除や、硫黄を使用した害虫駆除が行われてきました。17世紀になるとタバコ粉、19世紀初頭には除虫菊や、ごく微量で魚に猛毒を現すロテノン(フェニルプロパノイド;維管束植物で見られるポリフェノール化合物の一部)を含有するマメ科のデリス根を利用した殺虫剤が用いられるようになりました。それらは天然物や無機化合物が中心で、化学合成された有機化合物の農薬が登場するのは、20世紀に入ってからでした。
人類の歴史をさかのぼると、農作物への病害虫による被害は古くからあり、被害防止のための耕作方法や品種の改良など様々な努力が行われてきました。
元来、植物には昆虫による食害や菌類・ウイルス感染を避けるため、各種の化学物質を含有、または分泌するアレロパシー(ある植物が他の植物の生長を抑える物質を放出したり、または動物や微生物を防いだり、もしくは引き寄せたりする効果の総称)と呼ばれる能力があります。複数種類の植物を同時に栽培するコンパニオンプランツ(野菜や花と一緒に植えることでよい影響をもたらす植物のこと)をすると、連作障害を防止できることは経験的に知られていました。
古代ギリシアや古代ローマでは、播種(はしゅ)前の種子を、植物を煮出した液やワインに漬けておく方法や、生育中の苗にバイケイソウ(ユリ目シュロソウ科シュロソウ属に属する多年草で高山植物)などの植物の浸出液を散布する方法がとられていました。
19世紀に入ると、コーカサス地方で除虫菊の粉末が殺虫剤として使用されたほか、デリス根の殺虫効果が知られるようになりました。1824年には、モモの「うどんこ病」に対して、硫黄と石灰の混合物が有効であることが発見され、その後、1851年にフランスで殺虫・殺菌作用を持つ農薬の一種である石灰硫黄合剤(腐った玉子や硫黄を含む温泉の臭気がする液体)が考案されました。
19世紀後半には、木材の防腐剤として用いられていた硫酸銅が、種子の殺菌にも用いられるようになりました。1873年にボルドー大学教授のフランス人植物学者ピエール=マリー=アレクシス・ミラルデ(1838年~1902年)が、ブドウの「べと病」に硫酸銅と石灰の混合物が 有効であることを発見し、1882年以降、ボルドー液として農薬に利用されるようになりました。
1924年に、ドイツ人化学者ヘルマン・シュタウディンガー(1881~1965年)らによって、除虫菊の主成分がピレトリン(除虫菊に含まれる殺虫成分の一つ)という化学物質であることが解明されました。1932年には日本の農芸化学者、武居 三吉(たけい さんきち;1896~1952年)らによって、デリス根の有効成分がロテノンという化学物質であることが解明されました。
20世紀前半までは農薬の中心は天然物や無機物でしたが、第二次世界大戦後になると本格的に化学合成農薬が利用されるようになりました。
DDTとは「ジクロロ・ジフェニル・トリクロロエタン」の略です。1873年にオーストリアの化学者オートマール・ツァイドラー(1850~1911年)によって初めて合成されましたが、その後長い間そのままにされ、忘れられていました。
1938年、スイス人の化学者パウル・ヘルマン・ミュラー(1899~1965年)は、スイス・バーゼルのガイギー社(現在のノバルティス社)において合成染料の防虫効果の研究からDDTに殺虫活性があることを発見し、DDTはその後、農業・防疫に応用されました。ミュラーは、「虫が薬を食べなければ死なないというのでは効き目が弱い。虫の体についただけで、麻痺させるような毒性(接触毒)がつくれないものか?」と考え、天然物質や合成物質を調べました。そして、接触毒を持ち、しかも日光にも強い殺虫剤DDTを発見しました。ミュラーは、ジャガイモ畑を荒らすカブトムシの幼虫にDDTをふりかけました。すると幼虫はすぐに地面に落ち、翌朝にはみな死んでいました。DDTは、蚊、ハエ、シラミ、ナンキンムシ、ノミなどの昆虫に強力な殺虫力を発揮し、安価であったために世界中で広く使われました。
時を同じくして、ちょうど時代は第二次世界大戦の最中でした。戦争に不衛生はつきものです。DDTの高い殺虫性が戦場における疫病の回避に役立ち、兵士の健康を維持できることを知ったイギリスとアメリカは、1943年頃にDDTを工業化し、マラリアや発疹チフスといった病気を媒介する蚊やシラミを退治して、患者を激減させることに成功しました。
終戦後、日本に入ってきたアメリカ軍は発疹チフスを媒介するシラミの撲滅のために、日本人の体に真っ白になるほどDDTをかけて回りました。空襲により街が破壊され衛生状況の悪くなった当時の日本では、発疹チフスにより数万人規模の死者が出ると予想されていましたが、DDTの殺虫効果によって予防に成功し、1950年代には日本で発疹チフスの患者が見られなくなりました。
DDTは日本だけでなく、発展途上国などで、昆虫が媒介する感染症の撲滅に一役買いました。DDTの殺虫効果の発見の功績により、1948年、ミュラーがノーベル生理学・医学賞を受賞したのは、感染症への貢献があったためでした。
DDTの発見に刺激され、1940年代には世界各国で殺虫剤の研究が始まり、1941年頃にフランスでベンゼンヘキサクロリド(C6H6Cl6、シクロヘキサン環が持つ6個の炭素のそれぞれに塩素原子と水素原子がひとつずつ結合した有機塩素化合物)が、1944年頃にドイツでパラチオン(ダニ駆除の殺虫剤、バイエルン社の商品名がホリドール)が、アメリカでディルドリン(ナフタレンを基本とする環状構造を有する塩素化炭化水素の殺虫剤)がそれぞれ発明されました。いずれも高い殺虫効果があり、またたく間に先進国を中心に世界へ広がっていきました。一部の殺虫薬は第二次世界大戦に使われた毒ガスの研究から派生したものといわれています。
DDTは安価で殺虫力が強いので、当初「夢の化学物質」として積極的に使われ、食糧の増産や感染症の撲滅を支えました。使用開始から30年の間に全世界で300万トン以上のDDTが散布されたと推定されています。これは地球の全陸地の表面(148,647,000km2)がうっすらと白くなるほどの量でした。
1962年にアメリカ人の生物学者レイチェル・カーソン(1907~1964年)が出版した著書『沈黙の春』を発表してから環境運動が世界的な関心を集めて、農薬の過剰な使用に批判が起こるようになりました。カーソンは、DDTなどの有機塩素系殺虫剤が長期にわたって環境中に存在し、生態系に悪影響を及ぼすことを指摘しました。有機塩素系殺虫剤は脂溶性の非常に安定した物質で、動物の脂肪に蓄積され、「プランクトン→魚→鳥」という食物連鎖を通して徐々に濃縮されていきます。
カーソンは、アメリカのカリフォルニア州にあるクリア湖で、ブユ(カ亜目ブユ科に属する昆虫で、哺乳類や鳥類から吸血する衛生害虫)などの昆虫が大量発生した際に駆除用に散布されたDDD(ジクロロ・ジフェニル・ジクロロエタン;DDTの構造中で、トリクロロメチル基⦅-CCl3⦆がジクロロメチル基⦅-CHCl2⦆となった殺虫剤)が生物濃縮によって、カイツブリ(水中にもぐって魚を捕食する鳥)の体内で、DDD濃度が環境の17万8500倍にもなり、大量死を引き起こした出来事を例にあげました。DDDはDDTとよく似た有機塩素系殺虫剤です。
カーソンの「沈黙の春」の出版後、作品の中で否定的に書かれていた、DDT、DDD、アルドリン(シクロジエン系の殺虫剤)、ディルドリンなどは、その使用が禁止または厳しく制限されるようになりました。1972年、アメリカでDDTの使用は環境保護のために制限され、1983年には有機塩素系農薬の生産が1962年の生産量に比較して1/3以下に減少しました。産業界は、持続性が少なく、生体内に蓄積しない農薬の開発と生産を目指しました。
日本でも、有機塩素系農薬は1969年に国内向け製造が禁止され、1972年に使用禁止となりました。その後、水俣病などの公害が社会問題となるなか、1974年には小説家、有吉佐和子(1931~1984年)の小説「複合汚染」が発表され、農薬と化学肥料の危険性が訴えられました。有機塩素系農薬は、1980年代までに先進国では使用禁止になりましたが、一部の発展途上国においてはマラリア予防のために使用されました。

マラリアは、HIV(ヒト免疫不全ウイルス)/AIDS(エイズ)や結核とともに世界三大感染症の一つとして、公衆衛生上の大きな脅威になっています。これら三種の感染症による死者は毎年250万人で、なかでもマラリアは毎年数十万人の命を奪っています。そして死者の93%が熱帯熱マラリアの多いサハラ以南のアフリカに集中しています。おそらく人類を最も殺戮してきた感染症はマラリアで、マラリアを媒介するハマダラカを駆除してきたDDTほど人類を救った物質は無いと言われ、救った人命の数は5000万人とも1億人とも推定されています。
しかし、その後DDTに耐性を持つハマダラカが出現したため、結局、DDTはハマダラカを殺さず強化しただけだとも言われています。農薬や殺虫剤の開発とその耐性を持つ昆虫の登場は、今後も繰り返される「いたちごっこ」と言えるでしょう。
文献:
ウィキペディア・フリー百科事典
「農薬」「海葱」「ロテノン」「デリス根」「アレロパシー」「コンパニオンプランツ」「バイケイソウ」
「石灰硫黄合剤」「ヘルマン・シュタウディンガー」「ピエール=マリー=アレクシス・ミラルデ」
「ピレトリン」「武居三吉」「ロテノン」「DDT」「Othmar Zeidler」「パウル・ヘルマン・ミュラー」
「ベンゼンヘキサクロリド」「パラチオン」「ディルドリン」「レイチェル・カーソン」「沈黙の春」「ブユ」
「ジクロロ・ジフェニル・ジクロロエタン」「アルドリン」「有吉佐和子」「ハマダラカ」
2023年11月1日
「化学の泉」投稿文(その22)/豆知識(はじまりシリーズ)
【化学電池の歴史】
電池は、光や熱、化学反応などのエネルギーを電気に変換する装置で、化学反応によって電気を作る「化学電池」と、熱や光といった物理エネルギーから電気を作る「物理電池」の2種類に大別されます。「化学電池」は、物質自身が持つ化学的なエネルギーを化学反応によって直流の電力に変換する電池です。
異なる2種類の金属を電解液と組み合わせると、「化学電池」ができます。このとき、イオン化傾向が小さい方すなわち酸化還元電位が高い方の金属がプラス極となり、イオン化傾向の大きい方すなわち酸化還元電位がより低い方の金属がマイナス極となります。電池ではプラス極側で還元反応が起こり、マイナス極側で酸化反応が起こります。2種類の金属のイオン化傾向の差が大きいほど、化学電池の起電力は大きくなります。
たとえば、亜鉛と銅を使う「レモン電池」では、レモンの果樹が電解液になり、亜鉛(標準電極電位:-0.763V)がマイナス極に、銅(標準電極電位:+0.347V)がプラス極になります。このイオン化傾向は「Zn>Cu」となります。
化学電池の基本構成は、電極/活物質、電解質、セパレータ、容器から構成されます。「電極」は電流を流すために、2つ対にして設ける導体です。「活物質」は化学反応を起こして、電子を送り出し受け取る酸化/還元反応を行う物質です。単純な構造の電池では「電極」が「活物質」を兼ねているものがあります。「電解質」は溶媒中に溶解した際に、陽イオンと陰イオンを電離する物質です。「セパレータ」はプラス極とマイナス極を隔離し、電解液を保持してプラス極とマイナス極の間のイオン電導性を確保する部材です。「容器」は電池の外形を成し、電極/活物質、電解質、セパレータといった内部の構成物質を収めて閉じ込める役割を果たします。
最古の化学電池の一種ではないかと論争となっているバクダッド電池はバクダッド近郊で発掘された古代イランのアルサケス朝パルティア時代(紀元前247年~紀元後224年)の土器の壺です。1978年に西ドイツのヒルテスハイム博物館で開催された「シュメール・アッシュール・バビロン展」で「パルティア時代の電池と推定される器具」として展示されたことで世界中に広く紹介されましたが、電池であるという意見と、そうでないとする意見が在り、今も論争中です。
現在の化学電池の元祖となるものが発明されるきっかけとなったのは、1791年イタリア人医師で解剖学者のルイージ・ガルヴァーニ(1737~1798年)が、カエルの解剖をする際に切断用の鉄製のメスと固定用の銅製のメスの2つをカエルの足に差し入れると、死んでいるはずのカエルの足がピクピク動くことを発見したことでした。実はこのとき、鉄がマイナス極、銅がプラス極、そしてカエルが電解液となって電気が発生していたのですが、ガルヴァーニは動物にもともと存在している電気がカエルの筋肉を収縮させたのだと考え、「動物電気」という名前で発表しました。ガルヴァーニ本人は、電気は生体が発するものだと考えており、化学電池を作ったわけではありませんでしたが、この「ガルヴァーニの発見」が電気に関する発見の口火になりました。
同時代のイタリア人自然哲学者アレッサンドロ・ボルタ(1745~1827年)はガルヴァーニの実験からさらに研究を進めて「ボルタ電池」を発明しました。ボルタは電気を起こすもととなっているのはカエルではなく、実験に用いた鉄と銅の2種類の金属の接触に由来すると考え、カエルの代わりに食塩水を染み込ませた紙や革を使って電気を起こすことに成功しました。そしてさまざまな物質を組み合わせて実験を繰り返した末、1800年に、マイナス極に亜鉛板、プラス極に銅板、そして電解液に希硫酸を用いた、最初の化学電池であるボルタ電池を発明しました。イオン化傾向は「Zn>H>Cu」となり、マイナス極の亜鉛は、希硫酸に含まれる水素イオンよりイオン化傾向が大きいために電子を失って2価の陽イオン(Zn2+)となり、電子は導線を伝わって銅板に流れ、水素イオン(2H+)と反応して水素ガスとなって放出されます。
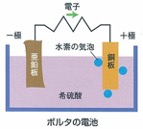
この発明を機に、電気や磁気が研究の対象として注目されるようになり、1826年にドイツ人物理学者ゲオルク・オーム(1789~1854年)はボルタ電池について研究を行い、導体にかかる電位差とそこに流れる電流には正比例の関係があるという「オームの法則」を発見しました。
1831年にイギリス人の自然哲学者マイケル・ファラデー(1791~1867年)は直流電流を流した電気伝導体の周囲の磁場を研究し、物理学における電磁場の基礎理論を確立しました。また、後にイギリス人の理論物理学者ジェームズ・クラーク・マクスウェル(1831~1879年)が発展させ、「電磁誘導の法則」「反磁性」「電気分解の法則」などを発見しました。これらの法則は、電気物理学における数々の重要な発見につながりました。
ボルトの功績を称えて、彼の名前は電圧の単位を表わす「ボルト」として現在も残っています。また、電流を測る「ガルバノメーター」はガルヴァーニの名前に由来しています。
しかし、ボルタ電池には、まだ改良すべき点がありました。希硫酸から発生する水素の気泡が銅板電極の表面に付着して電気を流れにくくする「分極」が発生して、すぐに起電力がなくなる欠点や、亜鉛板が希硫酸に溶けてボロボロになってしまい長時間使うことができない欠点がありました。そこで1836年にイギリス人の化学者であり物理学者のジョン・フレデリック・ダニエル(1790~1845年)が、素焼きの容器で電解液を分離し、プラス極側に硫酸銅(CuSO4)水溶液、マイナス極側に硫酸亜鉛(ZnSO4)水溶液を用いることによって起電力の変化が少なく、気体も発生しない実用性が向上した「ダニエル電池」を考案しました。ダニエル電池は放電を持続させるため、ZnSO4水溶液の濃度を薄く、CuSO4水溶液の濃度を濃くする電解質濃淡電池(陽極と陰極に同じ金属を用いても、陽極と陰極の電解質の濃度が違った場合は電池になる)の原理も応用できました。これは、翌1837年に電信機が発明されると、その電力源としておおいに活用されました。
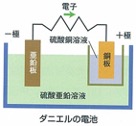
その後1868年に、フランス人の電気技師ジョルジュ・ルクランシェ(1839~1882年)が、より安全性が高い塩化アンモニウム溶液を電解液に、また二酸化マンガン(塩化アンモニウム溶液から発生する水素を水に変えて、水素ガスの気泡の発生を防ぐ働きをもつ)の中に入れた炭素棒をプラス極に用いた、現在のマンガン乾電池の原型となる「ルクランシェ電池」を発明しました。
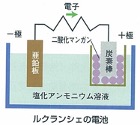
さらに、1887年に、ドイツの医師で科学者のカール・ガスナー(1855~1942年)が、持ち運びの際にこぼれないように塩化アンモニウム溶液を石膏(材質中に多くの孔があいているため、イオンの移動が可能)で固めた電池を発明して特許を取得しました。これは乾いた電池という意味で「乾電池」と呼ばれるようになりました。
日本人の時計技師で実業家の屋井先蔵(1864~1927年)が1885年に、ダニエル電池(湿電池)で動作する連続電気時計を発明しましたが、液体の入った湿電池の性能に不満を抱き、1887年に、より取扱いが簡素でまた日本の寒冷地でも使用可能な「乾電池」の発明に成功しました。屋井は、塩化アンモニウム溶液を石膏でペースト状に固め、腐食しやすい正極にはロウをしみこませるなどの工夫を重ねて「屋井乾電池」を発明しましたが、特許の申請費用が用意できなくてすぐには出願できず、日本における最初の乾電池の特許は通信省の電気技師高橋市三郎(生没年不詳)によって取得されました。
すぐに発表できなかったために、ガスナーの方が有名になってしまいました。
その後も素材や構造の研究開発が続けられ、さまざまな種類の小型全固体電池が実用化されました。そして、現在では使用する機器によって、それぞれにふさわしい電池が使い分けられるようになりました。
例えば、懐中電灯のように時々しか使わないものや、時計のように小さな電力で動くものには、休ませると回復する性質がある、正極兼減極剤として二酸化マンガン、負極に亜鉛、電解液に塩化亜鉛を用いた「マンガン乾電池」や、ヘッドフォンステレオや電子ゲーム機のように連続して使用するものには、マンガン乾電池に比べ寿命が長い、正極に二酸化マンガンと黒鉛の粉末、負極に亜鉛、電解液に水酸化カリウムを用いた「アルカリ乾電池」、またカメラや電子手帳には、小型でしかも長時間にわたり大きな電力を供給できる、正極にリチウム遷移金属複合酸化物、負極に炭素材料、電解質に有機溶媒などの非水電解質を用いた「リチウムイオン電池」などが使い分けられています。
ところで燃料電池も、燃料(多くは水素)と酸化剤(多くは酸素)の化学エネルギーを、一対の酸化還元反応によって電気に変換する電気化学電池です。燃料電池は、「水の電気分解」と逆の原理で発電します。すなわち、水の電気分解が、水に外部から電気を通して水素と酸素に分解するのに対し、燃料電池はその逆で、水素と酸素を電気化学反応させて電気を作ります。
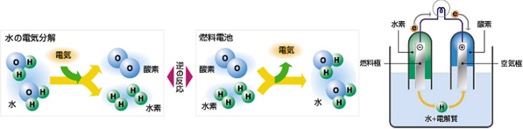
通常、化学電池の化学エネルギーは、電池内に既に存在する物質から得られますが、燃料電池は、燃料と(通常は空気からの)酸素が供給される限り、継続的に電気を作り出すことができます。燃料電池が他の多くの化学電池と異なる点は、化学反応を維持するために燃料と酸素を継続的に供給する必要がある点です。燃料電池にはさまざまな種類がありますが、いずれも陽極と陰極、そしてイオン(多くは正電荷の水素イオン)を行き来させる電解質で構成され、その電解質は燃料電池の両側面に存在します。すなわち、陽極では電極触媒(Pt[白金]系)によって燃料が酸化反応を起こし、イオン(多くの場合、正電荷の水素イオン)と電子が生成されます。そして、イオンは電解質を通って陽極から陰極に移動し、同時に電子は外部回路を通って陽極から陰極に流れ、直流電気を発生させます。陰極では、別の触媒によってイオン、電子、酸素が反応し、水やその他の物質が生成されます。
1839年、イギリス人の科学者ウィリアム・グローブ(1811~1896年)は、電気化学の分野に強い関心を抱き、ボルタ電池を研究して、気体ボルタ電池という燃料電池の原型を考案しました。
その後、1932年にイギリス人の技術者フランシス・トーマス・ベーコン(1904~1992年)が、水素-酸素燃料電池を発明して以来、燃料電池は1世紀以上にわたって商業利用されてきました。ベーコンは、当時まだ実用化が進んでいなかった燃料電池の改良で大きな業績を挙げ、実用化へ前進させました。アルカリ電解質形燃料電池(水酸化物イオンをイオン伝導体とし、アルカリ電解液を用いた燃料電池)は、発明者の名前をとってベーコン型燃料電池とも呼ばれ、1960年代以降、アポロ計画からスペースシャトルに至るまで、NASA(アメリカ航空宇宙局)は燃料電池を電源、飲料水源として使用されました。
それ以来、燃料電池は他の多くのアプリケーションにも使用されています。具体的には、商業施設、産業施設、住宅、遠隔地やアクセスが困難な場所での一次電源やバックアップ電源として使用されています。また、フォークリフト、自動車、バス、列車、ボート、オートバイ、潜水艦などに搭載した燃料電池で発電し、電動機の動力としても使用されています。
近年では、化石燃料の枯渇に伴うエネルギー問題、大量のエネルギー消費による環境汚染、CO2排出に伴う地球温暖化問題を解決するため、燃焼後に水しか出ない水素が、クリーンエネルギー源として期待されています。
それに伴い、燃料電池は水素を燃料として電気エネルギーを作るので、CO2を排出しない水素社会のエネルギー製造手段として期待されています。
文献:
ウィキペディア・フリー百科事典
「電池」「乾電池」「化学電池」「バクダッド電池」「ガルヴァーニ電池」「ルイージ・ガルヴァーニ」
「ボルタ電池」「アレッサンドロ・ボルタ」「ゲオルク・オーム」「マイケル・ファラデー」
「ジェームズ・クラーク・マクスウェル」「ダニエル電池」「電解質濃淡電池」
「ジョン・フレデリック・ダニエル」「マンガン乾電池」「ジョルジュ・ルクランシェ」「ガスナー乾電池」
「カール ガスナー」「屋井先蔵」「マンガン乾電池」「アルカリ乾電池」「リチウムイオン電池」「燃料電池」
「ウィリアム・グローブ」「フランシス・トーマス・ベーコン」
電池の歴史1 屋井乾電池 | 一般社団法人 電池工業会 (baj.or.jp)
2023年10月1日
「化学の泉」投稿文(その21)/豆知識(はじまりシリーズ)
【分子論の歴史】
分子とは、2つ以上の原子から構成される電荷的に中性な物質を指します。分子には、酸素分子「O2」のように1つの化学元素の原子からなる等核分子と、水「H2O」のように2つ以上の元素からなる異核分子があります。物質は原子から構成され、その原子が結びついて分子をつくります。この結び付きを化学結合と呼び、これを理解することで化学は発展してきました。
化学結合は分子内にある原子同士をつなぎ合わせる分子内結合と分子と別の分子とをつなぎ合わせる分子間結合とに大別されます。化学結合を作る力は原子の中で正の電荷を持つ原子核が、別の原子の中で負の電荷を持つ電子を電磁気力によって引きつける事によって結合されます。化学結合の定式化には、複数の原子がある場合において電子の軌道を決定する必要があり、そのためには量子力学(分子や原子あるいはそれを構成する電子などを対象としたミクロな物理現象を記述する力学)が必須となります。
化学における分子論の歴史は、2つ以上の原子間での電子対の共有にともなう強い化学結合(共有結合)が存在するという概念や考え方の起源をたどるものです。
今日の分子の概念の起源をたどると、古代ギリシアの哲学者デモクリトス(紀元前460年~紀元前370年)や、その師として原子論を創始して紀元前440年~紀元前430年頃に活動したレウキッポス(生没年不詳)までさかのぼることができます。デモクリトスはこれ以上小さな粒にすることができない『原子(アトム)』と空っぽの空間、現代の科学の言葉で言えば『真空(ケノン)』について考え、『万物は原子と真空からできていて、その他には何もなく、無数の原子が、原子以外は無い空っぽの空間の中で激しく絶え間なく動き回っている』と主張しました。紀元前450年頃、四元素説を唱えた古代ギリシアの哲学者エンペドクレス(紀元前490年頃~紀元前430年頃)は、基本元素(火、土、空気、水)と、それらの元素が集合離散をくり繰り返し相互作用する引力と斥力という『力』を唱え、さらに西洋最大の哲学者の一人と称された古代ギリシアの哲学者アリストテレス(紀元前384年~紀元前322年)が四元素説を拡張して『不壊(ふえ)の真髄⦅原子が堅固で壊れない根拠⦆』である第5元素(エーテル)を天体の基本的な構成要素として提唱しました。彼らは物質の固さは関係する原子の形に対応すると推論し、たとえば鉄の原子はフック(鉤、かぎ)を持ち、しっかりと噛み合っている固体で、水の原子は滑らかで滑りやすく、塩の原子は味が鋭く尖っていて、空気の原子は軽くて渦を巻き、他のすべての物質に浸透していると考えました。デモクリトスは感覚に基づく類推によって、原子をその形、大きさ、および部品の配置によって区別し、原子の姿を図示して、結合は原子に備わった連結器による物質的結合でフックアンドアイ(鉤と目)やボールアンドソケット(球と球受け)であると説明しました。
その後、これらの思想が中世およびルネサンス期のヨーロッパに受け継がれ、19世紀には酸素分子のように単一の化学元素の原子からなる安定した分子や、例えば水のように水素や酸素などの異なる化学元素の個々の原子が結合して化学的に安定した分子を形成することが実験的に証明され、徐々に分子の近代的な概念に発展していきました。
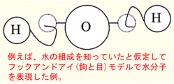
11世紀以降スコラ学(西方教会のキリスト教神学者・哲学者などによって確立された学問)の台頭とローマ帝国の衰退により、さまざまな四元素説やその後の錬金術説が支持されるようになり、原子論と共に分子論も長い間放棄されましたが、17世紀になると、フランスの哲学者で物理学者のピエール・ガッサンディ(1592~1655年)やイングランドの自然哲学者で天文学者のアイザック・ニュートン(1643~1727年)の業績を中心に原子論が復活し、同様に分子論も復活しました。
ガッサンディは、古代ギリシアの哲学者エピクロス(紀元前341年~紀元前270年)の自然哲学を深く研究して、空洞内を移動する原子の大きさや形を説明することで、物質の性質を説明できると推論し『熱さは小さくて丸い原子によるものであり、寒さは先端が尖った角錐型の原子によるもので、この形状が厳しい冷たさによる刺痛となる。固体は原子のフックが互いに噛み合うことで結合する』と説きました。
ニュートンは、「フック型原子」、「接着型原子(静止状態の物体)」、「共同運動による結合」などのさまざまな原子結合論を認め、粒子は何らかの力で互いに引き合い『直接接触すると非常に強く、短い距離では化学操作を起こし、粒子から遠くないところまで届いて何らかの影響を及ぼす』と考えました。
より具体的には、アイルランドの自然哲学者で化学者のロバート・ボイル(1627~1691年)が1661年に出版した有名な著書『懐疑的化学者』の中で、『物質は微粒子の集団から構成されており、化学変化はその集団の再編成によって生じる』と仮説を立て、物質の基本要素は『微粒子』と呼ばれる種類や大きさの異なる粒子で構成されており、これらの粒子は自身を集団に編成することができると主張しました。
さらにフランスの化学者ニコラ・ルメリ(1645~1715年)は、光の粒子説(光の本質は粒子であると仮定すると説明が容易な多数の実感の存在を根拠にした仮説)に基づいて、分子は点と細孔の幾何学的な錠によって結合された微粒子から構成されていると考え、『あらゆる酸性物質は尖った粒子から構成され、アルカリ性物質はさまざまな細孔を持つ』という概念を規定しました。
18世紀に入ると、1718年に元素の親和力の表を作ったことで知られるフランスの化学者エティエンヌ・フランソワ・ジョフロア(1627~1731年)は、ボイルによる集団の組み合わせの概念を土台にして、ある種の錬金術的な『力』が特定の構成要素を引き寄せるという考えを基に、粒子の組み合わせを説明する『化学的親和力による結合』の理論を構築したことで、『原子の組み合わせ』としての結合という考え方の前身となりました。
1738年にスイスの物理学者で数学者のダニエル・ベルヌーイ(1700~1782年)は、気体分子運動論の基礎となる『流体力学』を発表し、『気体はあらゆる方向に移動する多数の分子で構成され、それらが表面に衝突することで我々が感じる気体圧力が発生し、我々が熱として感じるものはその運動エネルギーに他ならない』と現在も使われている主張を展開しました。しかし、エネルギー保存の法則がまだ確立されておらず、また、分子間の衝突が完全に弾性的であることが物理学者の間で明らかでなかった為に、この理論はすぐに受け入れられることはありませんでした。
1789年にアイルランドの化学者ウィリアム・ヒギンズ(1763~1825年)が、原子価結合(化学結合を各原子の原子価軌道に属する電子の相互作用によって説明する手法)の概念のまえぶれとなる『究極粒子』の組み合わせと呼ぶものについて『例えば、酸素の究極粒子と窒素の究極粒子の間の力は6であり、力の強さはそれに応じて分割され、他の究極粒子の組み合わせについても同様である』という考えを発表しました。
19世紀に入ると、1803年にイギリスの化学者ジョン・ドルトン(1766~1844年)は、原子が『噛み合って』分子を形成していると誤って想像していたので、最も軽い元素である水素の原子量を1として、たとえば無水亜硝酸(三酸化二窒素;N2O3)の比率は2対3であり、『N2O3』という式を得ると判定しました。その後、1808年に有名な『結合した原子の図』を発表しました。
『分子』という言葉はイタリアの化学者で物理学者のアメデオ・アヴォガドロ(1776~1856年)が作り出しました。1811年の論文で、『気体の最小粒子は必ずしも単純な原子ではなく、これらの原子が特定の数だけ引力で結合して一個の分子を形成している』と提唱しました。彼はヴェルチェッリ王立大学の物理学教授を務めていた1811年に、現在のアボガドロの法則と呼ばれている『同温・同圧のもと、同体積の気体は同数の分子を含む』という仮説を宣言しました。この法則は、同じ温度と圧力のもとで、同じ体積の異なる気体の質量の間に生じる関係が、それぞれの分子量の間の関係に対応することを意味します。そのため、気体試料の質量から相対分子量を計算することができるようになりました。アボガドロの業績のうち最も重要な功績の一つは、単純な粒子も分子で構成され得ることと、その分子が原子で構成されていることを認め、両者を明確に区別したことです。

こうした考え方に同調して、1833年にフランスの化学者マルク・アントワーヌ・オーギュスト・ゴーダン(1804~1880年)は、アボガドロの原子量に関する仮説を、直線状の水分子のような半正確な分子形状と、H2Oのような正確な分子式の両方を示す『体積図』を使って分かりやすく説明しました。
1858年にドイツの有機化学者フリードリヒ・アウグスト・ケレク(1829~1896年)は、有機分子のすべての原子が他のすべての原子にどのように結合しているかについての理論を初めて提示し、『炭素原子は4価であり、互いに結合して有機分子の炭素骨格を形成することができる』と提唱しました。
その1ヶ月後、スコットランドの化学者アーチボルト・クーパー(1831~1892年)は、ほとんど同一の分子構造の理論を発表しました。原子と原子の結合を実線で表す方法を初めて採用し、いくつかの分子では原子の直鎖を仮定し、エタノールやシュウ酸の分子構造をまっすぐな「点線」を用いて表現して、『原子は互いに結合して特定の立体構造をとる』と非常に具体的な考えを提示しました。
1861年、ウィーンの無名の高校教師ヨハン・ヨーゼフ・ロシュミット(1821~1895年)が自費出版した『化学研究 I』という冊子に環状構造と二重結合構造の両方を示す先駆的な分子像を掲載しました。
1865年、ケレクがベンゼンの現代的な構造を最初に提唱し、後にアイルランドの結晶学者キャスリーン・ロンスデール(1903~1971年)がベンゼンの環状である特徴を確認しました。ベンゼンは、すべての結合を説明するために、炭素の二重結合が交互に存在しなければならないという点で、特別な問題を提示しました。
また同年、ドイツの化学者アウグスト・ヴィルヘルム・フォン・ホフマン(1818~1892年)は、英国王立研究所の講義で使用するメタンなどの分子模型を球と棒で初めて作成しました。しかし、ホフマンのモデルは、炭素の結合が四面体ではなく平面で示されていることや、球の大きさが水素よりも炭素が小さいなど、原子の大きさが比例していない基本的に幾何学的な分子模型ではありませんでした。
1864年、スコットランドの有機化学者アレキサンダー・クラム・ブラウン(1838~1922年)は、原子の記号を円で囲み、それぞれの原子の価数を満たすように破線でつないだ分子の絵を描きました。
1873年、スコットランドの著名な物理学者であるジェームス・クラーク・マクスウェル(1831~1879年)が、有名な論文『分子』を発表し、その冒頭で『原子とは2つに切断できない物体であり、分子とは、ある特定の物質の可能な限りの最小部分である』と「分子」の概念を明確に述べました。
1874年、オランダの化学者ヤコブス・ヘンリクス・ファント・ホッフ(1852~1911年)とフランスの化学者ジョセフ・アキール・ル・ベル(1847~1930年)は、炭素原子と隣接する原子との化学結合が正四面体の角に向いていると仮定することで、光学活性の現象が説明できることを、独自に提唱し、これによって、分子の立体的な性質がよりよく理解できるようになりました。
1898年、オーストリアの物理学者ルートヴィッヒ・ボルツマン(1844~1906年)は『気体論講義』の中で、原子価理論を用いて気相分子の解離現象を説明し、その際に原子軌道の重なりの初歩的かつ詳細な図を初めて描きました。ボルツマンはこの中で、『2つの原子の感度領域が接触しているか、一部が重なっている場合のみ、2つの原子の間に化学的な引力が生じ、そのとき、両者は化学的に結合していると言う』と述べました。
20世紀に入ると、1904年にドイツの化学者リヒャルト・アベッグ(1869~1910年)が『特定の数の電子を持つ元素が安定している』というアベッグ規則を指摘しました。同じころ、アメリカの化学者ギルバート・ニュートン・ルイス(1875~1946年)は、ハーバード大学で学部生を教える際に、原子の周りの電子を表すために点を使うようになり、これが学生たちに好評でした。ルイスは、アベッグ規則に着目して、原子核の周りに8個の電子の核が形成されると、その層が満たされ、新しい層が始まると考えました。加えて、8個の電子を持つさまざまなイオンも、特別な安定性を持っていることにも注目して、『8個の電子で満たされた層を持つイオンや原子は、特別に安定である』という「オクテット則」を提唱しました。さらに、立方体に8つの角があることに着目して、原子は立方体の角のように電子が利用できる8つの側面を持っていることに気づき、立方体原子がその側面で結合して立方体構造の分子を形成するという概念を考案しました。ルイスは1912年にカリフォルニア大学バークレー校に移り、その翌年に原子のマグネトン理論(磁気電子として知られていた亜原子粒子を電子と陽子と素粒子として扱った物理モデル)を提唱したイギリスの化学者で物理学者のアルフレッド・ラック・パーソン(1889~1970年)がまだ大学院生のころの論文の下書き、『電子は単なる電荷ではなく、小さな磁石であり、さらに化学結合は2つの原子の間で2つの電子が共有されることによって生じる』を読みました。ルイスは1916年、こうした考えを基に、有名な論文『原子と分子』の中で原子や分子を表すための『ルイス構造式』を導入しました。ルイス構造式では、点は電子を、線は共有結合を表し、2つの原子が1個から6個の電子を共有することで、単電子結合、単結合、二重結合、三重結合を形成する電子対結合の概念を打ち立てました。さらに、分子の構造を構成する各原子を化学記号で表し、結合している原子と原子の間には線が引かれ、場合によっては線の代わりに点の組が使われることもありました。また、孤立電子対を形成する過剰電子も点の組で表され、それらが存在する原子の横に配置されました。そして、ルイスは『1つの電子は2つの異なる原子の殻の一部を形成することができ、どちらか一方にのみ属することがなく、原子は立方体を完成させるのに必要な数の電子を得たり失ったりすることでイオンを形成する傾向がある』と提唱しました。
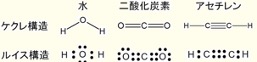
1927年、ドイツ人でアメリカに帰化した物理学者フリッツ・ロンドン(1900~1954年)とドイツの物理学者ヴァルター・ハイトラー(1904~1981年)は、水素分子における可飽和性で非動的な交換力(引力と斥力)の取り扱いに原子価結合の観点から新しい量子力学を適用した共同論文を発表しました。
1931年にアメリカの量子化学者ライナス・ポールング(1901~1994年)は、ロンドンとハイトラーの研究、およびルイスの有名な論文に見られる理論を基に、量子力学を用いて分子の性質や結合角・結合に伴う回転といった構造式を計算する画期的な論文『化学結合の本性』を発表し4つのsp3混成 軌道が水素の1s軌道に重なって4つのσ結合を形成するCH4のような分子の結合を説明する混成理論を展開しました。これらの優れた理論が評価され、ポーリングは1954年にノーベル化学賞を、1963年にはノーベル平和賞を受賞しました。
1926年、フランスの物理学者ジャン・ペラン(1870~1942年)は、ガンボージ石鹸(オトギリソウ科フクギ属の高木[ガンボージ]から採取した天然樹脂で作った黄色の石鹸)のようなエマルジョンを用いて、ブラウン運動を実験的に研究し、さらには、アインシュタインの液相における粒子回転の理論を検証することでアボガドロ定数を決定し、分子の存在を証明したことでノーベル物理学賞を受賞しました。
1951年、ドイツの物理学者アーウィン・ウィルヘルム・ミュラー(1911~1977年)は、電界イオン顕微鏡(尖鋭化した試料先端部を実空間実時間で観測できる投影型の顕微鏡)を発明し、初めて原子を見ることに成功しました。
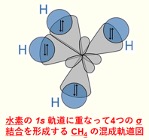
2009年、IBMの研究者は、原子間力顕微鏡(試料の表面と探針の原子間にはたらく力を検出して画像を得る顕微鏡)を使用して、初めて実際の分子の写真を撮ることに成功し、ペンタセン分子のすべての原子と結合を画像化しました。
古よりヒトは、2つ以上の原子の間に存在する化学結合の概念や考え方を追究して、ついに原子や分子の画像化に成功しました。そして、現代の化学は、原子・分子レベルでの物質の構造や性質を解明して、また新しい物質や反応を構築して、「物質とはなにか」に関する知見を積み上げる学問へと成長しました。
文献:
ウィキペディア・フリー百科事典
「化学の歴史」「化学結合」「共有結合」「分子論の歴史」「デモクリトス」「レウキッポス」「エンペドクレス」
「アリストテレス」「スコラ学」「ピエール・ガッサンディ」「アイザック・ニュートン」「ロバート・ボイル」
「ニコラ・ルメリ」「エティエンヌ・F・ジョフロア」「ダニエル・ベルヌーイ」「William Higgins」
「ジョン・ドルトン」「アメデオ・アヴォガドロ」「Marc Antoine Auguste Gaudin」「アウグスト・ケレク」
「アーチボルト・クーパー」「ヨハン・ヨーゼフ・ロシュミット」「キャスリーン・ロンスデール」
「アウグスト・ヴィルヘルム・フォン・ホフマン」「アレキサンダー・クラム・ブラウン」
「ジェームス・クラーク・マクスウェル」「ヤコブス・ヘンリクス・ファント・ホッフ」
「ジョセフ・アキール・ル・ベル」「ルートヴィッヒ・ボルツマン」「リヒャルト・アベッグ」
「ギルバート・ニュートン・ルイス」「Alfred Lauck Parson」「フリッツ・ロンドン」
「ヴァルター・ハイトラー」「ライナス・ポールング」「ジャン・ペラン」「ガンボージ石鹸」
「Erwin Wilhelm Müller 」「電解イオン顕微鏡」「原子間力顕微鏡」
2023年9月1日
「化学の泉」投稿文(その20)/豆知識(はじまりシリーズ)
【ガラスの歴史】
液体をある有限の速さで冷却していくと結晶化せずに過冷却液体になります。さらに冷却を続けると結晶化することもありますが、多くの場合は準安定なアモルファスな固体、すなわちガラスになります。この過冷却液体からガラスに移り変わることをガラス転移といいます。
固体の結晶を加熱していくと融点で液体に変わり始め、固体と液体が共存する間は温度が融点に維持され、固体が全て液体に変わると、またその温度が上昇していきます。しかし、非晶質の固体を加熱した場合は、低温では結晶なみに堅く(剛性率が大きく)流動性がなかった(粘度が測定不可能なほど大きかった)固体が、ある狭い温度範囲で急速に剛性と粘度が低下し流動性が増します。このような温度がガラス転移点です。ガラス転移点より低温の非晶質状態をガラス状態といい、ガラス転移点より高温では物質は液体またはゴム状態となります。非晶質でもゴム状態のように柔らかいものはガラスとは呼びません。
ガラス転移点をしめす代表的な物質には、合成樹脂や天然ゴムなどの高分子や昔から知られたケイ酸塩のガラスがあります。
古代から知られてきたケイ酸塩を主成分とする硬く透明な物質は、グラス、玻璃(はり)、硝子(しょうし)とも呼ばれていました。「硝子」と書いて「ガラス」と読ませる事もよくあります。化学的にはガラス状態となるケイ酸化合物(ケイ酸塩鉱物)です。他の化学成分を主成分とするガラスから区別したい場合はケイ酸ガラスまたはケイ酸塩ガラスと呼びます。いわゆる「普通のガラス」であるソーダ石灰ガラスのほか、ホウケイ酸ガラスや石英ガラスも含まれています。
ガラスには多くの種類がありますが、その多くは可視光線(400~760nm)領域を透過し、硬くて薬品にも侵されにくく、表面が滑らかで汚れを落としやすい特性があります。このような特性を利用して、窓ガラスや鏡、レンズ、食器(グラス)など市民生活および産業分野において広く利用されています。近代以前でも装飾品や食器に広く利用されていました。また金属表面にガラス質の膜を作った「琺瑯(ほうろう)」も近代以前から知られていました。
ガラスの表面に細かな凹凸を付けた磨りガラスや内部に細かな多数の空孔を持つ多孔質ガラスは、反射光が散乱するため、不透明です。遷移金属や重金属の不純物を含むガラスは着色するものがあり、色ガラスと呼ばれています。
ケイ酸塩鉱物はケイ酸塩で構成された造岩鉱物の総称です。一般的には、化学式[SiO2+n]2n-のサブユニットからなる無機化合物で、地球の地殻(地球の固体部分の表層部)の約90%を占めています。黒曜石など天然ガラスの利用は石器時代までさかのぼります。斑晶(ガラス質または細粒の結晶からなる石基の中に散在する大きな結晶)をほとんど含まないガラス質の流紋岩で黒色ガラス状の見かけのものを黒曜岩と呼びます。流紋岩は二酸化ケイ素SiO2(シリカ)をもっとも多く(約70%以上)含む火山岩で、結晶構造は大きく異なりますが、同じ火成岩で深成岩に分類される花崗岩と、含まれる成分は似ています。黒曜石は火山から噴き出した溶岩が熱いうちに水と接触して黒色ガラス状に固まったものです。流紋岩は酸性岩であり火山の多くが爆発的噴火をして火山灰やデイサイト(SiO2が63~70%でアルカリ成分の少ない火成岩の一種)として拡散してしまうため、急冷されてガラス質になる条件が必要な黒曜石は特定の場所でしか採れませんでした。
石器時代において、黒曜石はその切れ味の良さから石包丁や矢じりの石器素材として広く使われてきました。黒曜石は青銅器の発明以前において最も鋭利な刃物を作ることのできる物質だったので、交易品として珍重され、産出地域から遠く離れた地域で出土することが珍しくありません。刃物として使える鋭さを持つ黒曜石は、金属器を持たない人々にとって重要な資源でした。現にヨーロッパ人の来訪まで鉄を持たずに文明を発展させた中南部アメリカでは、15世紀頃まで黒曜石を使用していました。メキシコのアステカ文明やペルー、ボリビア、エクアドルのインカ文明などでは黒曜石を挟んだ木剣や石槍などの武器が中心で、人身御供で生贄の身体に使う祭祀用ナイフもつくっていました。一説にはアステカが強大な軍事力で周辺部族を征服し帝国を作れたのは、この黒曜石の鉱脈を豊富に掌握していたからだとも言われています。
ガラスの歴史は古く、紀元前4000年より前の古代メソポタミアで作られたガラスビーズが起源とされています。出土するガラスビーズは原料に金属不純物などが混ざっていたために青緑色に着色し不透明です。
最初のガラスは、二酸化ケイ素(シリカ)の表面を融かして作製したもので、ガラスそれ自体を材料として用いていたのではなく、陶磁器などの製造と関連し、釉薬にガラスの原料と同じような物質が使われていたので、焼くと表面が焼結体と呼ばれるガラス質に変化します。こうしてできたものが、最初につくられたガラスではないかと考えられています。
古代ガラスは砂、珪石、ソーダ灰(無水炭酸ナトリウム)、石灰などの原料を1200℃以上の高温で溶融し、冷却・固化するというプロセスで製造されていました。ガラス製造には大量の燃料が必要なため、ガラス工場は森に置かれ、燃料を木に頼っていました。そのため、その森の木を燃やし尽くしたら次の森を探すというように、ガラス工場は各地の森を転々と移動していました。ガラス工場が定在するようになったのは石炭と石油が利用されるようになってからです。また、このガラス製造の燃焼技術が青銅器や鉄器を作る冶金技術に応用されました。
紀元前2000年代までにエジプトや西アジアで、一部の植物灰や天然炭酸ナトリウムを混ぜてシリカを熱すると融点が下がることが分かり、これを利用して溶融によるガラスの加工が可能になり、鋳造ガラスの製造が始まりました。
エジプトでは紀元前1550年ごろに、粘土の型に流し込んで器を作るコア法が開発され、様々な技法のガラス容器が作製され、その製法が西アジアへ広まりました。
メソポタミアの新アッシリア(紀元前911~紀元前609年)のニムルドでは、サルゴン2世(紀元前722~紀元前705年)の銘入りの壷や象嵌のガラス板数百点が出土しています。アケメネス朝ペルシャ(紀元前525~紀元前330年)では、新アッシリアの技法を継承したガラス容器が作られました。
紀元前4世紀から紀元前1世紀のエジプトでは王家の要求によって高度な技法のガラスが作られ、ヘレニズム文化を代表する工芸品の一つとなっています。
エジプトのアレクサンドリアで、熔解炉などで高温溶融されたガラスを、吹き竿と呼ばれる金属管の端に巻き取って、竿の反対側から息を吹き込んで成形する「宙吹き」と呼ばれる製造法が紀元前1世紀の後半に発明されました。この技法は現代においても使用されるガラス器製造の基本技法で、これによって安価なガラスが大量に生産され、食器や保存器として用いられるようになりました。この技法はローマ帝国全域に伝わり、ローマガラスと呼ばれるガラス器が大量に生産され、その一部は東アジアにまで伝わりました。この時期には板状のガラスが鋳造されるようになり、ごく一部の窓にガラスが使用されるようになりました。また、ヘレニズム的な豪華なガラスも引き続き製造されていました。しかしローマ帝国の衰退とともにヨーロッパでの技法が停滞しました。一方、東ローマ帝国の治める地中海東部やサーサーン朝ペルシャや中国大陸の北魏や南朝では、引き続き高水準のガラスが製造されていました。日本には、漢代に中国から伝わり、弥生時代の須玖五反田遺跡(福岡県)などにガラス玉の工房があったことが確認されています。
5世紀頃、シリアでクラウン法の原形となる板ガラス製造法が生み出されました。これは一旦、手吹き法によりガラス球を造り、遠心力を加えて平板状にするもので、仕上がった円形の板を、適宜、望みの大きさや形に切り出すことができるメリットがありました。また、この技法によって凹凸はあるものの一応平板なガラスを製造することに成功しました。ガラス板は小さいものしかつくれなくても、鉛を使ってガラス板をつなぐと、大きなガラス窓になりました。

イスラム圏では8世紀にラスター彩色の技法が登場しました。この技法は陶器にも用いられましたが、先にガラスに使われました。9世紀から11世紀の中東では、カット装飾が多用されました。また、東ローマ帝国では盛んにステンドグラスが製造されました。
8世紀頃から、西ヨーロッパでもガラスの製作が再開され、12世紀には教会にゴシック調のステンドグラスが備わるようになり、13世紀には不純物を除いた無色透明なガラスがドイツ南部やスイス、イタリア北部に伝来しました。
良質の原料を輸入できたヴェネツィアのガラス技術は名声を高め、1291年にヴェネツィア共和国はガラス工とその家族をすべてムラーノ島に集め、ガラス産業の保護育成をはかりました。ここでは精巧なガラス作品が数世紀にわたって作られ、15世紀には酸化鉛と酸化マンガンの添加により屈折率の高いクリスタルガラスを完成させ、色ガラス、エナメル彩色、レースグラスなどの美しい装飾と高度なガラス工芸技術が開花しました。やがてヴェネツィアのガラス技術は各地に伝わり、16世紀には北ヨーロッパやスペインでも盛んにガラスが製造されました。この頃、中央ドイツやボヘミアでもガラス工房が増えています。これは原料となる灰や燃料の薪が豊富であり、かつ河川沿いにあり都市への物流に好都合だったためです。
また、15世紀には西欧各地でさかんにステンドグラスが製造されました。当時の平坦なガラスは吹いて作ったガラスを延べてアイロンがけすることで作られていました。
1670年代に入ると、精製したガラス原料にチョーク(白墨)または酸化鉛を混ぜることで、無色透明なガラスを作る製法がドイツ・ボヘミア・イギリスの各地で、同時多発的に完成しました。この手法によって厚手で透明なガラスが得られ、高度な装飾のカットやグレーヴィング(縦や横に溝を刻む技法)が可能になり、重厚なバロックガラスやロココ様式のガラスが作られました。
アメリカ合衆国のヴァージニア州ではヨーロッパからの移民が始めたガラスの生産が18世紀末になると豊富な森林資源を背景に大規模な資本の投下が可能になり、工場生産が行なわれるようになりました。
18世紀に入ると、フランスで熱い融けたガラスを大きな鉄の台に広げ、重い金属ローラーで圧し伸ばす板ガラスの鋳造法が開発され、また同時期に吹きガラス法を利用して大型の円筒を作り、それを切り開いて板ガラスを製造する方法が開発され、この2つの方法は20世紀初頭にいたるまで板ガラス製造の基本技術となりました。
1791年には炭酸ナトリウムの大量生産法が、フランスの医師で化学者のニコラ・ルブラン(1742~1806年)によって発明されました。18世紀の後半、ヨーロッパでは産業革命によって織物工業が急速な発展を遂げましたが、織物を製造する工程で、原糸を洗ったり、仕上げの段階で織物についたロウ等の不純物を洗い落としたりするために、石鹸の需要が拡大しました。当時、ガラスや石鹸の原料となる炭酸ナトリウムの原料は海藻や木材の灰だけでした。しかし、森林資源の枯渇などの原因で、海草灰や木灰だけでは急激に増える炭酸ナトリウムの需要を満たすことが困難になりました。特にフランスでは、スペインとの王位継承戦争に敗れたために、スペイン産の天然炭酸ナトリウムが輸入出来なくなり、事態はとても深刻でした。1775年、食塩に炭酸ナトリウムの成分が含まれていることは既に周知だったのでフランス科学学士院は安価な塩化ナトリウムから需要の多い炭酸ナトリウムを製造することを推進するために、豊富にある海水を利用した食塩から炭酸ナトリウムを作り出す製造方法を高額な賞金を懸けて募集しました。その発明に成功したのがニコラス・ルブランです。オルレアン家の私的な侍従医を務めるかたわら化学の研究をしていた彼は、食塩と硫酸から作った硫酸塩を石灰や木炭などとともに炉で焼いた後、それを洗い、水に溶け出した成分を濃縮して、炭酸ナトリウムの結晶を取り出す方法(ルブラン法)を発明しました。海水中の食塩と硫酸を原料として用いたニコラ・ルブランの方法に対して賞は授与され、後に1年間に320トンの炭酸ナトリウムを製造する彼自身の工場がオルレアン公の援助によりパリの北に位置するサンドニに稼働しました。石灰や木炭という安価で手に入れやすい材料で炭酸ナトリウムを作ることが出来るようになったことから、ルブラン法を用いた炭酸ナトリウム製造工場が各地に建てられ、原料供給が大きく改善されました。
19世紀に入ると、原料供給や炉に大きな進歩が相次いで起き、ガラス工業の近代化が急速に進みました。1861年にはベルギーの化学者で実業家のエルネスト・ソルベー(1838~1922年)によってより経済的なソルベー法が開発され、さらにソーダ灰(無水炭酸ナトリウム)の増産が進み、炭酸ナトリウムから作るソーダ石灰ガラスの製造が主流になりました。エルネスト・ソルベーは子どもの頃から科学への関心を持ち中等学校の先輩から科学の専門的知識を学んではいたものの、病気のため大学進学を断念し21歳で叔父の化学工場で働き始め、この工場でのアンモニアの活用法から1861年に、無水炭酸ナトリウムの製造法を開発しました。
さらにガラスを溶かす窯にも大きな進歩が起きました。1856年に、イギリスの電気技師で実業家のカール・ウィルヘルム・シーメンス(1823~1883年)により、平炉(蓄熱炉とも呼ばれる)の構造が発明され特許が取得されました。この蓄熱式槽窯を用いた製法により、溶融ガラスの大量供給が可能となりました。この平炉法はガラス炉として成功し、以後の工業的ガラス製造の基本となり、その後にフランスの製鋼技術者ピエール・エミール・マルタン(1824~1915年)により改良が加えられ製鋼にも使用されました。こうしたガラス供給の増大によって価格が低落し、また瓶や窓ガラス、さらには望遠鏡や顕微鏡といった光学用のガラスなどの用途・需要が急増したため、各国に大規模なガラス工場が相次いで建設されるようになりました。1851年には世界初の万国博覧会であるロンドン万国博覧会が開催されましたが、そのメイン会場として建設された水晶宮は鉄とガラスによって作られた巨大な建物で、科学と産業の時代の象徴として注目を浴びました。19世紀末から20世紀初頭にかけてのアール・ヌーヴォー(ヨーロッパを中心に開花した国際的な美術運動)はガラス工芸にも大きな影響を与え、フランスのエミール・ガレ(1846~1904年)やアメリカのルイス・カムフォート・ティファニー(1848~1933年)などの優れたガラス工芸家が現れ、多くの作品を残しました。
1903年、板ガラス製造用の自動ガラス吹き機がアメリカで開発され、熟練工を必要としないことから各国に急速に普及しましたが、やがて機械による引上げ式にとって代わられました。1950年代、イギリスのガラス製造企業であるピルキントン社がフロートガラスの製造を開始しました。このフロートガラスの開発によって、現在使用されている板ガラスの基本技術が完成し、安価で安定した質の板ガラスが大量生産されるようになりました。
その後、1960年代にドイツの産業用ガラスのメーカーであるショット社がゾルゲル法で反射防止コーティングを実用化したことでゾルゲル法が産業界で認知され、ガラスの新しい製造法になりました。これまでガラスを製造する方法は原料を2000℃前後の高温によって溶融する必要がありましたが、ゾルゲル法ではガラスの原料となる化合物や触媒を有機溶液に溶かし込んで、数十℃の環境で加水分解と重合反応を経て、溶融状態を経由せずに直接ガラスを生成させます。実際は完成したゲルが気泡を含むため、最終的には1000℃程度に加熱して気泡を抜いてやる必要があります。この方法の発明によって、ガラスに限らず光ファイバーや平面ディスプレイなどの有機無機ハイブリッド材料の創製で、従来では考えられなかった用途が開かれてきています。近年では10000℃のプラズマを利用して原料を一瞬で溶かす方法が実用化に向けて開発中ですが、まだ実用化には至っていません。
現在、ガラスは食器や構造材のみならず、電子機器、光通信など幅広い分野で生活に必要不可欠なものとなっています。
文献:
ウィキペディア・フリー百科事典
「ガラス」「ガラス転移点」「ケイ酸塩鉱物」「黒曜石」「流紋岩」「花崗岩」「デイサイト」「アステカ文明」
「インカ文明」「新アッシリア」「サルゴン2世」「アケメネス朝ペルシャ」「クラウン法」「グレーヴィング」
「炭酸ナトリウム」「ニコラ・ルブラン」「エルネスト・ソルベー」「Carl Wilhelm Siemens」
「Pierre-Émile Martin」「アール・ヌーヴォー」「エミール・ガレ」「ルイス・カムフォート・ティファニー」
「ピルキントン社」「ゾルゲル法」「ショット社」
2023年8月9日
「化学の泉」投稿文(その19)/豆知識(はじまりシリーズ)
【金属アルミニウムの冶金術の歴史】
前回の「(その18)冶金術と鋼鉄の歴史」でもお話ししましたが、冶金術とは、鉱石その他の原料から有用な金属を「採取」「精製」「加工」して、種々の目的に応じた実用可能な金属材料「合金」を製造する技術です。紀元前2600年頃の古代エジプトでは「金」が貴金属になっていたことが知られています。
天然に単体として産出される金属は、金、白金、わずかに銀、銅、水銀などのイオン化傾向が小さい陽イオンになりにくい金属です。人類は初めにイオン化傾向の小さい金、白金、銀、水銀、銅を単体の金属として利用しました。それ以外のイオン化傾向が大きい金属は、自然界において酸化物ないしは硫化物として産出されるので、古代人は還元反応を知らないまま青銅器・鉄器などを製造する金属精錬を行いました。
アルミニウムは原子番号13、原子量26.98の元素であり、標準状態では明るい銀色の金属です。アルミニウムは地殻中で3番目に多い元素で鉄よりも多く含まれているため、人類の活動にも広く使われています。金属という形のアルミニウムが人類に使われてきた歴史は浅く、金属として取り出されたのは鉄よりもずっと遅く19世紀に入ってからです。アルミニウムを取り出すための原料は、ボーキサイト(酸化アルミニウムを含む鉱石)というオレンジ色の鉱石です。ボーキサイトを精製してアルミナを取り出し、氷晶石(ヘキサフルオロアルミン酸ナトリウム;Na3AlF6)を1012℃で融解してアルミナを溶解して電気分解すると陰極に金属アルミニウムが析出します。アルミナの成分は酸化アルミニウム(Al2O3)です。アルミニウムのイオン化傾向が大きいので、アルミニウムと酸素の結合は非常に強く、鉄鉱石ならコークスの燃焼温度1400℃程度で鉄と酸素の結びつきから酸素を外すことができますが、アルミナはコークスの燃焼ではびくともしません。アルミナの融点は2072℃と高く、さらに電気分解するためには液体にする必要がありました。これらの課題を解決するために金属アルミニウムを取り出すのに時間が掛かりました。

アルミニウムの歴史は明礬(ミョウバン)の使用で始まりました。明礬は硫酸カリウムアルミニウム十二水和物【AlK(SO4)2・12H2O】です。明礬の記述が最初に文書に残されたのは、紀元前5世紀の古代ギリシア歴史家ヘロドトス(紀元前484~425年頃)による記述でした。古代人にとって、明礬は媒染剤、そして要塞を敵の放火から守るための木の防火塗料であり、また沈殿材として上質の井戸がない場合、質の悪い水に明礬を入れて不純物を沈殿させて飲用に使うこともありました。さらに、明礬は白礬(ハクバン)とも呼ばれ、その収斂(しゅうれん)作用(タンパク質を変性させることにより組織や血管を縮める作用で止血、鎮痛、防腐などの効果がある)や殺菌作用から、医薬品や洗眼剤、うがい剤として用いられることもありました。しかし、金属アルミニウムは知られていませんでした。十字軍以降、明礬は国際貿易の商品の1つになり、ヨーロッパの織物業では媒染剤として欠かせない存在になり、地中海東部からヨーロッパに輸出されました。15世紀中期にオスマン帝国が明礬の輸出関税を大幅に上げましたが、1460年にローマ近くのトルファで埋蔵量の多い明礬鉱山が発見されたのでトルファから全ヨーロッパに輸出されるようになりました。
ルネサンス初期まで、明礬の性質は不明のままでしたが、1530年頃、後のフロギストン燃焼理論(『金属は灰とフロギストンが結合した状態で、木灰と金属灰を燃焼させることにより木灰のフロギストンが金属灰へ移る』と説いた)の起源となった三原理説(中世アラビアの錬金術師によって作り上げられた理論を発展させ、『硫黄・水銀・塩が燃焼すると、硫黄は消滅し、水銀は蒸発し、塩は灰として残る』と説いた)を唱えたスイス人医師のパラケルスス(1493~1541年)が明礬を硫酸塩と区別して「明礬の土の塩」であると主張していらい、ルネサンス期の科学者は明礬を新しい土類の塩と信じるようになりました。1595年、神聖ローマ帝国のドイツ人医師で化学者のアンドレアス・リバヴィウス(1555~1616年)は明礬を構成した未発見の土の名前を「アルミナ」と提唱しました。
17世紀後半から18世紀にかけてこの「新しい土類」が新しい金属の酸化物と証明されました。1782年、フロギストン説を打破し燃焼を「酸素との結合」として説明した「近代化学の父」と称されたフランス人化学者アントワーヌ・ラヴォアジエ(1743~1794年)はアルミナが金属の酸化物で、その金属と酸素の親和力が高くて、当時知られていた還元剤では還元できないと記述し、アルミーヌ(Alumine)と命名しました。ラヴォアジエは1794年に、化合物の体系的な命名法を作成したフランス人化学者ルイ=ベルナール・ギトン・ド・モルボー(1737~1816年)は1795年にそれぞれ木炭と純酸素を使用してアルミナを融解して白い液体にしましたが、金属は発見できませんでした。1807年、イギリス人化学者ハンフリー・デービー(1778~1829年)はアルカリ電池でアルミナの電気分解に成功しましたが、形成した金属にはアルカリ金属のナトリウムとカリウムが含まれていてそれらからアルミニウムを分離できませんでした。デービーはさらなる電気分解実験を試みましたが分離に失敗しました。1812年、デービーは実験中の新しい金属の名前に「アルミナム(aluminum)」を提唱し、この名が現代にいたるまで使用されることになりました。他の科学者は「アルミニウム(aluminium)」を使用しましたが、米国では現代までアルミナムが使われています。1815年、スウェーデン人の化学者で医師のイェンス・ヤコブ・ベルセリウス(1779~1848年)はアルミナの化学式をAlO3と示唆しましたが、正しい化学式のAl2O3は1821年にドイツ人化学者アイルハルト・ミッチェルリッヒ(1794~1863年)が確立し、後にベルセリウスがアルミニウムの原子量(27)を計算するのに役立ちました。
1825年、デンマーク人の物理学者で化学者のハンス・クリスティアン・エルステッド(1777~1851年)はこの新しい金属の発見を発表し、続いてドイツ人化学者フリードリヒ・ヴェーラー(1800~1882年)がエルステッドの発表に基づいて研究を行い、金属アルミニウムを発見しました。彼らはボルタ電池を用いた電気分解で析出させたアルミニウムよりイオン化傾向が大きい金属カリウムと塩化アルミニウムと混ぜて加熱し、金属カリウムが塩化アルミニウムの塩素を奪って塩化カリウムになることで金属アルミニウムを得ました。しかし、純粋な金属アルミニウムは精練が難しく、珍しかったため、発見直後の金属アルミニウムは価格が金よりも高く、1856年にフランス人化学者アンリ・エティエンヌ・サント=クレール・ドビーユ(1818~1881年)がカリウムより便利で安いナトリウムで塩化アルミニウムを還元することで、初の工業用精錬法を開発してようやく価格が下がりました。1867年のパリ万国博覧会ではアルミニウムのケーブルとアルミ箔が展示され、1878年のパリ万国博覧会ではアルミニウムが未来のシンボルになりました。しかし、ドビーユ精錬法は電気分解による製造が現れると廃れました。
1886年にフランス人化学者ポール・エルー(1863~1914年)とアメリカ人化学者チャールズ・マーティン・ホール(1863~1914年)がホール・エルー法を開発したことでアルミニウムが一般人にも使えるほど広まりました。ホール・エルー法は現代のアルミニウム精錬でも使われています。純アルミナの電気分解はアルミナの融点が極めて高いこと(2072 ℃)もあって現実的ではありませんでしたが、エルーとホールは氷晶石が酸化アルミニウムに溶け込みやすい性質を利用して氷晶石を1012℃で融解して酸化アルミニウムを混合することで融点を約800℃まで下げられることを発見し電気分解が可能になりました。電気分解すると、アルミニウムイオンが陰極から電子を得て金属アルミニウムとして陰極に析出しました。ホールとエルーはまったく独立に同じ方法を発見し、二人はそれぞれの国で特許を取得しました。しかも、二人とも1863年の生まれで、同じ50歳でこの世を去りました。ホール・エルー法がアルミナをアルミニウムに変える手法である一方、ハンガリー帝国のオーストリア人化学者カール・ヨーゼフ・バイヤーは1889年にバイヤー法というボーキサイト(鉄礬土)をアルミナに純化する手法を発見しました。彼はボーキサイトをアルカリとともに焼成して成分を水に溶出させ、溶液を攪拌して種晶(過飽和を制御するために使用される過飽和溶液に加える少量の結晶)を入れると、沈殿物が現れることを発見しました。この沈殿物とは水酸化アルミニウムであり、加熱するとアルミナに分解されます。その数年後には、アルミナを分離した後のアルカリ廃液が、ボーキサイトからアルミニウム成分を溶出させるために再利用できることが発見され、バイヤー法が工業で使用されるきっかけとなりました。現代の金属アルミニウム生産はバイヤー法とホール・エルー法に基づく手法を使用しています。
バイヤー法とホール・エルー法による工業化でアルミニウムの価格は下落し、19世紀末から20世紀にかけて宝飾、日用品、眼鏡フレーム、光学機械、食器やアルミ箔などに広く使用されるようになりました。また、アルミニウムは柔らかく軽いが、すぐにほかの金属と合金を形成することで密度の低さを維持しつつ硬さを上昇させられることができ、例えばアルミニウム青銅は曲げやすいバンド、シート、ワイヤーを製造するのに使われ、造船業や航空業で広く使われています。
アルミニウムのリサイクルは20世紀初期から始められ、アルミニウムがリサイクルで劣化せず繰り返して使えることもあり広まりました。しかし、大量の電力を必要とするアルミニウムは、電気の塊、あるいは電気の缶詰と言われています。
アルミニウムの電解による製法の原理は、マグネシウムなどの取り方にも応用されていて、現在の軽金属時代の糸口になっています。
文献:
ウィキペディア・フリー百科事典
「冶金」「ミョウバン」「ヘロドトス」「アルミニウム」「ボーキサイト」「アルミニウムの歴史」
「パラケルスス」「アンドレアス・リバヴィウス」「アントワーヌ・ラヴォアジエ」
「ルイ=ベルナール・ギトン・ド・モルボー」「ハンフリー・デービー」
「イェンス・ヤコブ・ベルセリウス」「アイルハルト・ミッチェルリッヒ」
「ハンス・クリスティアン・エルステッド」「フリードリヒ・ヴェーラー」
「アンリ・エティエンヌ・サント=クレール・ドビーユ」「ポール・エルー」
「チャールズ・マーティン・ホール」「バイヤー法」
2023年7月1日
「化学の泉」投稿文(その18)/豆知識(はじまりシリーズ)
【冶金術と鋼鉄の歴史】
古代社会において、炎は有機物の酸化反応によって放出される光と熱エネルギーの現れでした。化学の歴史は人類が火を扱いはじめたときから始まっているとも考えられます。のちの冶金術に道を拓くガラスの発見と金属の精錬を導いたのは火でした。
冶金術とは、鉱石その他の原料から有用な金属を「採取」「精製」「加工」して、種々の目的に応じた実用可能な金属材料「合金」を製造する技術です。冶金術の初期には金属精錬の方法が認められました。また、紀元前2600年頃の古代エジプトでは「金」が貴金属になっていたことが知られています。
天然に単体として産出される金属は、金、白金、わずかに銀、銅、水銀などのイオン化傾向が小さい陽イオンになりにくい金属です。人類は初めにイオン化傾向の小さい金、白金、銀、水銀、銅を単体の金属として利用しました。それ以外のイオン化傾向が大きい金属は、自然界において酸化物ないしは硫化物として産出されるので、古代人は還元反応を知らないまま青銅器・鉄器などを製造する金属精錬を行っていました。
金属器では青銅器がまず使われました。青銅は銅とスズの合金です。銅と酸素の結合はあまり強くないため、酸化銅でできた鉱石から簡単に銅を取り出すことができました。そこで、銅やスズを含んだ鉱石がある場所で焚火をしたときに、偶然に青銅ができたのだろうと考えられています。そして、この合金の発見は青銅器時代の幕開けを告げました。
やがて、薪の代わりに木炭を使うようになり、石を積んだ炉を発明して、炉に「ふいご」で空気を送り込めば高温になり反応が進みやすくなることを発見しました。紀元前2000年頃のエジプトの壁画には足踏みふいごと鋳型の絵が見られます。
酸化鉄の鉄と酸素の結びつきは、酸化銅の銅と酸素の結びつきよりもずっと強いために鉄を取り出すのは困難でしたが、炉の中で砂鉄と木炭を層状にして木炭を燃やせば400~800℃の温度で木炭の「炭素」と燃焼時の「二酸化炭素」が反応して「一酸化炭素」が生成し、この一酸化炭素が酸化鉄を還元することで赤熱状態のスポンジ状の鉄の塊が生成します(Fe2O3+3CO→2Fe+3CO2)。金床の上で、この鉄の塊を赤熱状態ままハンマーで叩いて鍛錬して不純物を絞り出すと、比較的純粋な「錬鉄(鋼鉄より炭素の含有量が少ない0~0.1%程度の極軟鋼)」が得られました。

古代に鉄づくりで栄えたのは紀元前2000年頃のヒッタイト帝国で、鉄製の武器でバビロニアを滅ぼしエジプトの新王国とも勢力を争いましたが、紀元前12世紀に帝国が滅びると鉄の精錬技術は周辺諸国に拡散し、「青銅器文明」から「鉄器文明」に移っていきました。青銅器時代ののち、軍がより高度な武器を求めたことで冶金術の歴史は新しい段階を迎えました。ユーラシアの諸国は高性能の合金を造り、これを使った甲冑や武器を製作すると全盛期を迎え、これはしばしば戦闘の結果を決定付けました。
古代インドのグプタ朝時代(320~550年)には冶金術と錬金術にめざましい進歩がみられました。グプタ朝時代は工業開発がめざましく、帝政ローマなどとの比較でも染色、製革、石鹸製造、ガラス、セメント、・・・などの化学工業分野では最も高度な技術を擁していたとみられています。6世紀までヒンドゥー教徒は化学工業の分野でヨーロッパよりはるかに先行しており、煆焼 (鉱石の加熱処理方法)、蒸留、昇華、蒸気加熱、不揮発性化、熱を伴わぬ発光、麻酔薬や睡眠剤の調合、金属塩・化合物・合金の調製などに熟達していました。鋼の焼鈍し技術は古代インドに持ち込まれて木目状の模様を特徴とするダマスカス鋼(古代インドで開発されたるつぼ鋼であるウーツ鋼)として完成されました。ダマスカス鋼の名は、シリアのダマスカスで製造されていた刀剣などの製品にウーツ鋼が用いられていたことに由来し、ダマスカス鋼の模様はるつぼによる製鋼における内部結晶作用に起因するものでした。このヒンドゥー教徒の化学と化学産業のほとんどは、ペルシア人がインドから入手して、中近東のアラブ人に伝え、アラブ人はヨーロッパに伝えました。
一方で鉄づくりの方法は中近東から南回りでインドへ、インドから江南(揚子江周辺地)へ、さらに日本へと伝わりました。日本で鉄の生産が始まったのは、弥生時代の後半から末期頃(350年頃)だと推定されています。日本では「たたら製鉄」による鉄づくりが発展しました。「たたら製鉄」では、炉に砂鉄(酸化鉄)と木炭を交互に入れて3日間火を入れ、「ふいご」で送風して火力を高めて精錬し「ケラ」と呼ばれる鉄の塊を取り出します。炉は最後には取り壊されるので、一回ごとに作り直されます。「ケラ」の中には良質の鋼(玉鋼)も含まれています。日本刀は、こうして作った「玉鋼」を叩き延ばしてはそれを折り返し、赤熱のまま叩いて接合する操作を数十回繰り返して作られます。
現在知られている最も古い高炉は、中国の前漢時代(紀元前100年頃)のものとみられています。高炉法では高温状態で還元されてできた鉄が炭素を吸収して、融点が下がるため、1200℃程度で溶けて、液体の銑鉄(鉄鉱石を還元して取り出した炭素の含有量4%前後の鉄の合金)を造ることができます。これは、水車を利用して炉に送風することで炉内の温度を高くできるようになったためです。高温で完全に溶解させ、液状にした銑鉄は、鋳型に流し込んで自由な形に造型することができました。
ヨーロッパにおける最初の高炉は、スウェーデンで12世紀から14世紀の間につくられました。しかし、この高炉が、独自の技術で作られたのか、モンゴルからもたらされた技術によって作られたのかははっきりしていません。高炉は中世を通じ、ヨーロッパ中の鉄鉱石のある地域へと伝播していきました。
ドイツでは、14世紀から15世紀に高炉法が始まりました。高炉でできた銑鉄は、炭素分が多く、ハンマーで叩くと脆く割れてしまいます。のち高炉で製造した銑鉄を溶かしたところに空気を送り込んで炭素を燃やして、炭素分の少ない錬鉄にする精錬技術が考案され、製鉄における高炉の役割は不動のものになりました。
中世までのイギリスは他のヨーロッパ諸国よりも海軍力や産業が遅れていたため木材消費量が少なく、カシやブナなどからなる豊かな森におおわれていましたが、ヘンリー8世(在位1509~1547年)がスペインの侵略に備えてイングランド南部の森の中で大砲や鉄砲などの兵器の生産にのりだしたのをきっかけにして製鉄産業が急速に発達しました。鉄づくりに多量の「木炭」を使ったことも原因し、17世紀末には森林が国土の16%までに減少しました。そこで木炭の代わりに、豊富にあった「石炭」が使われるようになりましたが、製鉄に石炭を使うと、石炭に含まれる硫黄分が不純物となり鉄が脆くなるため、そのまま利用できませんでした。1709年、イギリス人製鉄業者エイブラハム・ダービー(1678~1717年)が石炭を蒸し焼きにして硫黄分を取り除いた多孔質のコークスを用いることで、この問題を解決しました。その後、高炉法においても銑鉄を反射炉で石炭に空気を送り込んで燃やした熱で融かし、鉄の棒で攪拌することで、炭素分を燃やして錬鉄の塊を得るパドル法が開発されました。

イギリスでは1760年代からの産業革命の進展で、鉄の利用が広がるにつれて、銑鉄と錬鉄のいいところを取り入れた、堅くてしかも粘り気のある強靭な鋼鉄「鋼」(炭素含有量0.04~2%程度の鉄の合金)が求められるようになりました。1856年、イギリス人発明家ヘンリー・ベッセマー(1813~1898年)が開発した転炉法が強靭な鋼を量産するための第一歩となりました。ベッセマーは溶けた銑鉄に冷たい空気を吹き込んでも吹き込んだ空気中の酸素が銑鉄中の炭素やケイ素と反応するときに出る熱で鉄が固まることは無いと自身の科学的判断に従い、まわりの「鉄が固まってしまうのではないか?」と言う声にめげずに転炉に融けた銑鉄を入れ、冷たい空気を吹き込みました。吹き込まれた空気中の酸素によって、まず銑鉄中のケイ素が燃え、火花と熱いガスが吹き上がりました。さらに10分ほどすると、銑鉄中の炭素が燃えて炉は突然巨大な炎を吹き出し、この反応の熱によって炉内は1500~1600℃になり、やがて20分ほどで炭素分が減少して鋼ができました。わずか20分程度で数10トンの低炭素鋼が融けた状態で出てきました。仕上げに定量の炭素を加えて割合を調整し「鋼」を作ることができました。また、同年には炉の構造を改良して、炭素の少ない屑鉄を銑鉄と一緒に燃料を使った高熱で溶け合わせて平均して炭素の多い鋼にする「平炉法」がイギリス人電気技師カール・ウィルヘルム・シーメンス(1823~1883年)により発明され、フランス人製鉄技術者ピエール・エミール・マルタン(1824~1915年)により製鋼法が確立されました。さらに1878年 にベッセマーの転炉法ではできなかった、リン分が多い鉱石から鋼を作る「トーマス法」をイギリス人裁判所書記シドニー・ギルクリスト・トーマス(1850~1885年)と彼のいとこの製鉄所技術者パーシー・カーライル・ギルクリスト(1851~1935年)が共同で発明しました。こうして、鋼が大量生産されるようになっていきました。
1951年、融けた鉄の上から空気ではなく、ほぼ100%の酸素ガスを超音速で上部や底部から吹きかける「LD法(純酸素転炉)」がオーストリアで開発され、空気を用いた転炉法や平炉法は衰退していきました。第二次世界大戦後の20世紀後半は世界経済の急速な拡大で民生用としての鉄の需要が非常に大きくなりましたが、溶鉱炉が大型化したものの赤鉄鉱(主成分Fe2O3)などの鉄鉱石を溶鉱炉で還元して鉄を作る仕組みは基本的に変わっていません。
「鉄は国家なり」という言葉があります。これは19世紀にドイツを武力統一したプロセイン王国首相のオットー・フォン・ビスマルク(1815~1898年)の演説に由来しています。ベッセマーの転炉法によって鋼鉄製の大砲を作ったビスマルクは、プロセイン・フランス戦争(1870~1871年)で、青銅製大砲で宣戦布告したナポレオン3世が率いるフランス軍に圧勝して、1871年にドイツ帝国を建設しました。ビスマルクの言葉通り、大砲や鉄道、自動車などに欠かせない材料として鋼鉄は国力の源泉となり、その生産量は現在でも国力を示す重要な物差しになっています。
文献:
ウィキペディア・フリー百科事典
「冶金」「化学の歴史」「化学(歴史)」「銑鉄」「錬鉄」「鋼鉄」「鋳鉄」「ヒッタイトの歴史」「青銅器時代」
「鉄器時代」「グプタ朝」「ダマスカス鋼」「たたら製鉄」「高炉(歴史)」「エイブラハム・ダービー」
「ヘンリー・ベッセマー」「転炉」
「Carl Wilhelm Siemens」「Sidney Gilchrist Thomas」「Percy Carlyle Gilchrist」
「オットー・フォン・ビスマルク」
TSS文化大学一般教養講座「イギリスの森と鉄の歴史」;広島大学名誉教授 友田卓爾
2023年6月5日
「化学の泉」投稿文(その17)/豆知識(はじまりシリーズ)
【金と錬金術の歴史】
金の原子番号は貴金属としては最も大きい「79」です。金の反応性は低く、イオン化傾向は全金属中で最も小さく、酸化をほとんど受けないために、常温常圧下で単体として採掘できた人類が古くから知る固体金属です。宇宙において、金を含むあらゆる元素は、宇宙の進化とともに生成されてきました。特に鉄(原子番号26)よりも重い金のような元素は、中性子星合体(キロノヴァ)と呼ばれる高密度の天体が融合する際に起こる大規模な爆発現象で生成され、隕石として地球上に降り注ぎ、熱水鉱床(高温の熱水が岩石の割れ目を通過する際に様々な元素が沈殿してできた鉱脈)として鉱床が生成され、そのまま採掘されるか、風化の結果として生まれた金塊や砂金として採集され、金となりました。これまでに採掘されて精製加工された金の総量は、2019年末で水泳競技用の50メートルのプール四杯分程度の約20万トンで、埋蔵量の75%程度と推定されています。

砂金や自然金が豊富に含まれる土砂から金を採るためには、「パン」と呼ばれる洗面器のようなパンニング皿(側面に一定間隔で凸凹の刻みが入れてある皿)でふるい分けを行います。パンに土砂と水を入れてゆすると、密度の大きな砂金がより分けられます。
金鉱山で金鉱脈を含む岩を掘り進めるのは、長い間タガネとハンマーだけの手掘りでしたが、19世紀中頃に蒸気力による穴開け機・削岩機が現れてから、圧縮空気で動かすようになり、さらに油圧を使うようになりました。そしてダイナマイトが発明されると岩石を爆破し採掘するという革命的な進化を遂げました。こうして得られた鉱石は、古代では「石臼」と鉄の「杵」で粉砕されていました。15世紀には水力、つまり水車の動力を使うようになり、現代でもこれを改良した機械が用いられています。
粉砕した鉱石から金を分離するには、水銀に溶かし込むアマルガム法が古代から用いられていました。金は常温で液体の水銀に溶け込み、水銀との合金であるアマルガムを生成します。このアマルガムを加熱して水銀を蒸発させれば金が残ります。この方法は古代から知られていました。しかし、水銀は貴重な金属であり、アマルガム法に代わる方法が探し求められました。それが19世紀に導入されたシアン化法です。シアン化法は、シアン化カリウム(青酸カリ)水溶液が金を溶かすことを利用した方法です。細かく粉砕した鉱石を、シアン化カリウム水溶液のタンクに入れ、よく空気に触れるようにかき混ぜ、金をイオンとして溶かし込んだ溶液を作ります。この溶液に亜鉛を入れると、イオン化傾向が大きな亜鉛がイオンとなり金が析出します。シアン化法では金の含有量が少ない低品位鉱からも金を抽出することが可能になりました。
黄金色の美しい光沢を持つ金は化学的に非常に安定で腐食しにくいので、黄金色の輝きをいつまでも失いません。また精錬の必要がない単体の金が、そのまま自然界に存在しているため、精錬が必要な鉄などよりも早く、人類がもっとも古くから利用してきた金属の一つです。しかし産出量が非常に限られていたため、有史以前から貴重な金属、貴金属として知られ、世界中で通貨や装飾品として珍重されてきました。
旧約聖書には、メソポタミアのユーフラテス川下流域右岸のシュメール人が建設した都市国家ウルでは、紀元前3000年頃、すでに優れた金製の兜などが作られていた記載があります。紀元前3000~紀元前1200年頃栄えたトロイ、クレタ、ミケーネのエーゲ文明も金製品を多く残しています。紀元前600年~紀元前400年頃、南ロシア草原地帯を支配した騎馬遊牧民スキタイのスキタイ文化では、武器・馬具などに施された動物模様と豊富な金の使用が特徴でした。日本では、平安時代後期に金の産地となっていた奥州を掌握した奥州藤原氏の産金による経済力を背景に、平泉が平安京に次ぐ日本第二の都市に発展しました。砂金は平安京や北宋・沿海州などとの貿易に使用されました。奥州産の金をふんだんに使用した中尊寺金色堂は、マルコ・ポーロが「東方見聞録」で 紹介した黄金の国ジパングのモデルになったとされています。
長い年月を経ても変化しない金の性質は神秘性を産み、不老不死とも関連付けられ、人間の異常な欲望の源となり、中世の錬金術の流行を生み出すもととなりました。
錬金術は、狭義には化学的手段を用いて卑金属から貴金属(特に金)を精錬しようとする試みのことです。広義では、金属に限らず様々な物質や人間の肉体や魂をも対象として、それらをより完全な存在に錬成する試みを指します。
錬金術の起源は古代エジプトや古代ギリシアに求められます。エジプトのテーベの古代墓地から発掘された3世紀頃に書かれたとみられるパピルスには、金や銀に別の金属を加えて増量する方法や染色法が記述されていました。4世紀初めのアレクサンドリアのエジプト人錬金術師、パノポリスのゾシモス(生没年不詳)は膨大な著作を残しました。錬金術は、ヘレニズム文化の中心であった紀元前のエジプトのアレクサンドリアからイスラム世界に伝わり発展しました。万物は四元素(火、空気、水、土)から構成されていると考えたアリストテレス(紀元前384~紀元前322年)ら古代ギリシアの哲学者の物質観は、中世アラビアの錬金術に多大な影響をもたらしました。イスラム世界では、8~9世紀の200年ほどの短期間に、2~3世紀に「錬金術の始祖」と称されたヘルメス・トリスメギストス(生没年不詳)が著したと考えられた、神秘主義的な古代思想のヘルメス文書や、4~5世紀のギリシア系歴史家ゾシモス(生没年不詳)の著作、5~6世紀の新プラトン主義的文献といった錬金術にかかわるエジプトのギリシア語文献が、アラビア語へ翻訳されました。また、9世紀末にはアランピック蒸留器や硝酸、硫酸、塩酸、王水を発明したことで知られているバクダード人錬金術師ジャービル・ブン・ハイヤーン(721~815年)の著作に擬した、イスマーイール派というシーア派の秘教的分派の信奉者によって編纂された「ジャービル文書」や、10世紀初めにペルシア人錬金術師の著作群が編纂した「ラーズィー文書」などのイスラム錬金術師によって編纂された膨大な文献が残されました。
12世紀にはアラビア語へ翻訳された錬金術にかかわる多くの文献やイスラム錬金術師たちが残した多くの文献が、ラテン語に翻訳されてヨーロッパで盛んに研究されるようになりました。16世紀のルネサンス期には印刷技術の発展により先人の書物が広まり錬金術師が増えて錬金術は最盛期を迎えました。ルネサンス期の「医化学の祖」と呼ばれたスイス人医師で錬金術師のパラケルスス(1493~1541年)は錬金術の研究から、これまでの医学に化学を導入し、酸化鉄や水銀、アンチモン、鉛、銅、ヒ素などの金属の化合物を初めて医薬品に採用しました。錬金術の知識を医学に応用して、人間の健康を守る薬「エリクサー(金属変成や病気治癒を可能にする霊薬)」を求めました。
これは錬金術が近代的な「化学」に変容しうる機会でしたが、そうはならず、多くの錬金術師たちは「賢者の石(鉛などの卑金属を金に変える際の触媒になると考えた霊薬)」探しに終始しました。さらに偽の錬金術師も急増し、錬金術書を偽造したり、偽の金を売りさばいたりする者まであらわれました。何より彼らは実験に成功することなく具体的な成果を上げられず、徐々に錬金術は疑惑の目にさらされるようになりました。
錬金術の試行の過程で、硫酸・硝酸・塩酸など、現在の化学薬品の多くが発見され、実験道具が発明されました。こうして16世紀の錬金術が17世紀の自然科学を生み出したのです。17世紀後半になると錬金術師でもあったアイルランド人化学者のロバート・ボイル(1627~1691年)が四元素説を否定し、万有引力の発見で知られるイングランド人の物理学者で天文学者のアイザック・ニュートン(1642~1727年)も錬金術に深く関わり膨大な文献を残し、「近代化学の父」と呼ばれたフランス人化学者のアントワーヌ・ラヴォアジェ(1743~1794年)が著書で33の元素や「質量保存の法則」を発表するに至りました。
現代では原子核物理学と宇宙物理学の発展により、金よりも原子番号が一つ大きい水銀(原子番号80)の安定核種に中性子線を照射すると放射性同位体が生成され、これがベータ崩壊することで金の同位体が得られることが実証されていますが、これらは安定核種では無く放射性崩壊します。実用的に十分な金を生産するためには長い年月(半減期444年)と膨大なエネルギーが必要で、得られる金の時価と比べると現実的ではありません。
古代より金の財力としての価値が見いだされると、新たに金を採掘するよりも容易に金が得られる技術の開発が試みられてきました。金そのものの性質を調べることに加え、それまでの冶金術を基に、身近な金属や物質から金を作り出す研究が盛んに行われ、これが錬金術として確立されました。錬金術師たちは占星術からの引用で太陽を表す記号で金も表し、金を生み出すことができるとされた物質には「賢者の石」の名を与え、「賢者の石」を作ることに多くの努力を費やしましたが、その試みの全ては失敗に終わりました。しかし、得られた多くの成果は現在の化学や物理学の基礎となりました。
文献:
ウィキペディア・フリー百科事典
「金」「中性子星」「パンニング皿」「錬金術」「化学の歴史」「エーゲ文明」「スキタイ文化」「四元素」
「アリストテレス」「ヘルメス・トリスメギストス」「ヘルメス文書」「新プラトン主義」「イスマーイール派」
「アランピック蒸留器」「ジャービル・ブン・ハイヤーン」「アル・ラーズィー」「パラケルスス」
「エリクサー」「賢者の石」「ロバート・ボイル」「アイザック・ニュートン」「アントワーヌ・ラヴォアジェ」
株式会社平凡社世界大百科事典 第2版「ゾシモス」
2023年5月4日
「化学の泉」投稿文(その16)/豆知識(はじまりシリーズ)
【温度と熱と熱力学の歴史】
温度とは、物体の温冷の度合いを数量的に表す指標です。気温、水温、体温というように、温度はわれわれの日常生活と密接に関係している量です。温度は、化学反応において強い影響力を持ちます。また、生物にはそれぞれ至適温度があり、ごく狭い範囲の温度の環境下でしか生存できません。化学や生物学における観察や実験では、基礎的な条件として温度を記録する必要があり、あるいは温度を調整することが実験を成立させる重要な条件となります。
熱は高温の物体から低温の物体へと移動するエネルギーです。物理学的には物体間で熱のやりとりをする際に重要な役割を果たす熱平衡状態を指定するパラメーターの一つで、エネルギーが自然に移動していく方向を示す指標となります。もし、接触させてもエネルギーの移動が起こらない場合は二つの物体の温度が等しい温度平衡(熱平衡)にあると言えます。熱エネルギーは機械的なエネルギー(仕事)に変換することができ、熱はある系のエネルギーの変化から力学的な仕事を差し引いたものと定義されています。
初めて物体の寒暖の度合いを定量的に表そうと試みたのは「天文学の父」と称されるイタリア人の自然哲学者で天文学者のガリレオ・ガリレイ(1564~1642年)であるといわれています。ガリレイは、遅くとも1593年までには空気の熱膨張の性質を利用して空気を詰めたガラス球の管先を水に沈めて、管内の水の高さの変化によって気温を測定する温度計を発明しました。当時はまだ気圧計が発明されていなかったので、ガリレイの作った温度計は気圧などの影響を受けてしまうために実際に温度を定量的に表すことができませんでしたが、このように物質の温度による性質の変化を利用して、寒暖の度合いを定量的に表そうという試みはその後も続けられました。
初めて目盛付き温度計により数値によって温度を表現しようとしたのはデンマーク人の天文学者オーレ・レーマー(1644~1710年)でした。1702年頃、レーマーは足を骨折し、しばらくの間自宅に閉じ込められた機会を利用して、水の沸点を60度、水の融点を7.5度とする2つの固定点を持つ温度計を作製しました。
オランダで活動したドイツ人の科学機器製作技術者で物理学者のガブリエル・ファーレンハイト(1686~1736年)は、アムステルダムで科学装置の製造業に従事するとともに、ガラス器具を製作する技術を身につけて、1707年頃より10年間、ドイツなどの各国を旅して科学者と出会う中で、標準温度計の必要性を知りました。すでにファーレンハイトは1708年にレーマーを訪ねていて、標準温度計の作製にあたりレーマー温度目盛を参考にしました。さらに、当時の天文学者たちが使っていた水銀気圧計が気圧に関わらず正しい温度を示すことを知って、これを温度計に応用し、1713年頃から水銀温度計の実験を始めました。当時使われていたレーマー温度目盛では、冬の寒い日の温度にマイナスの値が出てきてしまって不便だったので、これを避けるために改良を加えました。ファーレンハイトが測ることのできた最も低い室外の温度を「0度」とし、彼自身の体温を「100度」にしようとして、最終的に「0度(-17.8℃)」を実験的に同量の氷・塩化アンモニウム・水を混ぜることによって得られる温度に固定し、さらに風邪で発熱したときの人間の体温と同じ羊の直腸温度(37℃)を「100度」として固定して、目盛を12等分し、さらに8等分して96度の目盛を作りました。人間が発熱すると体温が上昇して羊の体温と一緒になることから、昔からヨーロッパの言い伝えでは「人は風邪をひくと羊さんになる」と言われていました。こうして、1714年にファーレンハイトはそれまで一般的に使われていたアルコール類を使った液柱温度計の不正確さを、純度の高い水銀を使用するとともに精密な製作技術で精度を高めた水銀温度計を開発しました。しかし、氷・塩の混合物や羊の直腸温度は必ずしも一定でないため、1724年に、彼の考えた温度目盛で水の融点と沸点を計測し、その融点と沸点の間を正確に180度に区切り、最終的に水の融点を「32度」、沸点を「212度」と定めなおした温度目盛りを考案しました。さらに、自身が製作した温度計を使って、様々な液体の沸点を計測し、沸点が液体ごとに異なることや、大気圧によって変動することを発見しました。しかしファーレンハイトの計測が不正確だったので、オリジナルの目盛によって測定した水の融点・沸点が「32度」・「212度」とは異なっていたので、彼の死後にその値が「32度」・「212度」なるように調整され、その結果、人の体温は「96度」ではなく、「98.6度」となりました。日本ではファーレンハイトを中国語で“華倫海”と表記することから「華氏温度」と呼ばれ、単位はファーレンハイト(Fahrenheit)の頭文字をとって「°F」で表されています。
1742年、スウェーデン人の天文学者アンデルス・セルシウス(1701~1744年)によって、世界最初の実用的温度計が提唱されました。これは100分目盛の温度計でセルシウス温度計の基となりました。しかし、このセルシウスの提案は、水の沸点を「0度」、融点を「100度」とするもので、現在のセルシウス温度とは逆の目盛でした。そのため温室内の温度を測るのに不便だったので、1752年までに「分類学の父」と称されるスウェーデン人の植物学者カール・フォン・リンネ(1707~1778年)らにより目盛は水の融点「0度」、沸点「100度」に改められました。日本ではセルシウスを中国語で“摂爾修”と表記することから「摂氏温度」と呼ばれ、単位はセルシウス(Celsius)の頭文字をとって「°C」で表されています。
ところで、18世紀半ば過ぎまでは温度と熱の概念の区別が明確ではありませんでした。温度と熱の違いに初めて気が付いたのはスコットランド生まれのイギリス人物理学者で化学者のジョゼフ・ブラック(1728~1799年)であると言われています。ブラックは氷が融解している最中は熱を吸収しても温度が変化しないことから「潜熱」を発見しました。また温度の違う同質量の水銀と水を混ぜる実験を行い、それぞれ水と水銀の温度変化にある定数を掛けた量が常に等しくなることから、温度変化に乗ずる定数が熱容量に相当し、常に等しくなる量は移動する熱量であるという「熱容量の概念」を発見しました。これらの実験により温度と熱が異なる概念であることが確立され、熱に関する本格的な研究が始まり、これを受けて18世紀末には熱学が生まれました。「近代化学の父」と称されるフランス人の化学者アントワーヌ・ラヴォアジエ(1743~1794年)は熱の正体がわからなかったので、カロリック(熱素)という目に見えず重さのない熱の流体があり、これが流れ込んだ物体は温度が上がり、流れ出して減れば冷える、とするカロリック説が唱えました。この考えは多くの科学者によって支持され、19世紀半ば過ぎまで信じられていました。
一方、18世紀後半から19世紀にかけてイギリスでジェームズ・ワット(1736~1819年)により蒸気機関が発明され、飛躍的に発展を遂げましたが、その熱効率についての確固たる科学的理論はなく、開発はもっぱら経験的に進められたものでした。またこの頃気体の性質が研究され、1662年にアイルランド人の自然哲学者ロバート・ボイル(1627~1691年)によって「ボイルの法則」が発表され、1787年にフランス人の物理学者ジャック・シャルル(1746~1823年)によって「シャルルの法則」が発見され、1802年にフランス人の化学者で物理学者のジョセフ・ルイ・ゲイ=リュサック(1778~1850年)によって「ゲイ=リュサックの法則」が発表されました。最終的にはこれらの法則が「ボイル=シャルルの法則(理想気体の性質)」としてまとめられました。さらに19世紀に入ると効率の良い熱機関の開発の要請から熱力学の構築が進みました。1823年にフランス人の工兵隊大尉で物理学者のニコラ・レオナール・サディ・カルノー(1796~1832年)は蒸気機関の熱効率に限界はあるのか、そしてどうすれば効率を最大限に高めることが出来るのかを考え、仮想熱機関としてカルノーサイクルによる研究を行い、熱機関の効率には熱源と冷媒の間の温度差によって決まる上限があることを発見しました。このことから「外部から仕事がなされない限り、熱エネルギーは温度の高い物体から温度の低い物体にしか移動しない」という熱力学第2法則についての研究が進んでいきました。しかし、カルノーはカロリック説に捉われたまま36歳で早世したために、その重要性が認識されるにはさらに時間がかかりました。同様に、熱をエネルギーの1形態と捉え「エネルギー保存の法則」、つまり熱力学第1法則をはじめて提唱したドイツ人の物理学者ユリウス・ロベルト・フォン・マイヤー(1814~1878年)も、論文を1842年に発表しましたが全く注目されませんでした。
1843年にイギリス人の物理学者ジェームズ・プレスコット・ジュール(1816~1889年)は熱が仕事へと変換可能であると考え、熱の仕事当量(1calの熱量に相当する仕事の量)を求める測定を行いました。この研究も当初は全く注目されませんでしたが、1847年にアイルランド生まれのイギリス人物理学者ウィリアム・トムソン(1824~1907年)の知るところとなり、1849年にトムソンがカルノーの説を再発表する一方で、ジュールの説も否定せず、むしろこの発表で脚注として取り上げたことで、ジュールの理論をも広く知らせることになりました。さらにドイツ人の生理学者で物理学者のヘルマン・フォン・ヘルムホルツ(1821~1894年)は1847年の論文で、マイヤーの「エネルギー保存の法則」を再発表したことで、1850年にジュールやトムソン、ヘルムホルツの論文をもとにドイツ人の理論物理学者ルドルフ・クラウジウス(1822~1888年)がカルノーとジュールの説を統合し、熱力学第1法則および熱力学第2法則を完全な形で定義しました。クラウジウスによる熱力学第2法則はクラウジウスの原理と呼ばれていますが、1851年には、トムソンも別の表現で熱力学第2法則に到達し、トムソンの原理と呼ばれるようになりました。この両原理は同一のものであると簡単に証明できたことで、1850年代には熱力学第2法則が確立されました。さらに1854年にトムソンは、カルノーサイクルで熱源と冷媒に出入りする熱エネルギーから熱力学温度目盛が構築できることを示しました。熱力学温度においての1つの定義定点はカルノーサイクルの効率が「1」となる温度であり、これは摂氏温度目盛で表せば「-273.15℃」となりました。熱力学第2法則によれば、この温度に到達するには無限の仕事が必要となり、それより低い温度は存在しません。そのため、この温度を「絶対零度」と呼び、熱力学温度目盛ではこの絶対零度を原点「0 K(ケルビン)」として表しました。温度の下限の存在はトムソン以前にシャルルの法則から、あらゆる気体の体積が「0」となる温度として考えられていました。また、1865年にはクラウジウスが、カルノーサイクルの数学的解析からエントロピー(原子や分子の「乱雑さの尺度」で、断熱条件下での不可逆性を表す指標、何をすることができて、何をすることができないかを、その大小で表すような量)の概念の重要性を明らかにして、それを「エントロピー」と命名しました。さらに、19世紀後半になると、ヘルムホルツによって自由エネルギーが、またアメリカ人の数学者で物理化学者ウィラード・ギブス(1839~1903年)によって化学ポテンシャルが導入され、化学平衡などを含む広い範囲の現象を熱力学で論じることが可能になりました。
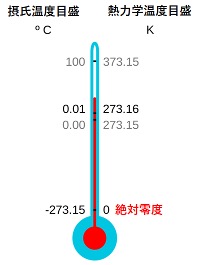
一方、原子や分子レベルにおける温度の意味については、イギリス人の理論物理学者ジェームズ・クラーク・マクスウェル(1831~1879年)の気体分子運動論によって初めて明らかとなりました。気体分子の並進運動(物体が行う運動のうち,それを構成するすべての点が同一の速度で移動する運動)の速度分布はマクスウェル分布に従い、この分布関数の形状は温度に依存していて、特に気体分子の並進運動エネルギーの平均値は3/2kT(k:ボルツマン定数、T:熱力学温度)となり、温度に比例することから、温度は分子の並進運動の激しさを表す数値でもあることが明らかになりました。その後、オーストラリア人の物理学者ルートヴィッヒ・ボルツマン(1844~1906年)はこのマクスウェルの考え方を発展させ統計熱力学を構築しました。統計熱力学では、あらゆる形態のエネルギーに「温度が高いほど高いエネルギーを持つ原子や分子の割合が大きくなり、原子や分子の持つ平均エネルギーの大きさも増加する」という考え方が拡張されました。このように統計熱力学において温度は分子の並進運動エネルギー分布の仕方を表す指標とされています。
その後、量子論が確立してくると、古典的な統計熱力学は量子統計の近似であることが明らかとなりました。例えば、統計熱力学においては「0 K」であらゆる粒子は運動を停止した最低エネルギー状態をとることになりますが、量子論において粒子は「0 K」でも零点エネルギーを持ち静止すること無く、零点振動(原子が極限までエネルギーを失ったとしても、不確定性原理のために静止せずに振動していること)をとります。しかし、量子統計でも温度が分子の並進運動エネルギー分布の仕方を表す指標であることは統計熱力学と変わりませんでした。
この様に発展してきた熱力学は現代において、熱エネルギーをいかに有効に機械的エネルギー(仕事)に変換するかを設計する上で、化学や工学等のきわめて広い分野にわたって応用されています。
文献:
ウィキペディア・フリー百科事典
「温度」「熱」「温度計」「ガリレオ・ガリレイ」「オーレ・レーマー」「ガブリエル・ファーレンハイト」「華氏」「アンデルス・セルシウス」「摂氏」「カール・フォン・リンネ」「ジョゼフ・ブラック」「アントワーヌ・ラヴォアジエ」「ジェームズ・ワット」「ロバート・ボイル」「ジャック・シャルル」「ジョセフ・ルイ・ゲイ=リュサック」「熱力学」「エントロピー」「ニコラ・レオナール・サディ・カルノー」「ユリウス・ロベルト・フォン・マイヤー」「ジェームズ・プレスコット・ジュール」「ウィリアム・トムソン」「ヘルマン・フォン・ヘルムホルツ」「ドルフ・クラウジウス」「ウィラード・ギブス」「ジェームズ・クラーク・マクスウェル」「ルートヴィッヒ・ボルツマン」
2023年4月8日
「化学の泉」投稿文(その15)/豆知識(はじまりシリーズ)
【火と燃焼理論と燃料の歴史】
人類の進化を見ると、初期猿人(サヘラントロプス)は約700万年前に、アフリカでチンパンジーとの共通祖先から分かれ、森林で直立二足歩行を始め、犬歯が退化しました。猿人(アウストラロピテクス)は約400万年前に、森林から草原にも出ていくようになり、安定した直立二足歩行が可能になりました。猿人の一部は脳が500ml以上になるなどの進化をとげ、ホモ属というグループを形成しました。原人(ホモ・エレクトス)は約200万年前に、アフリカで誕生しました。脳が拡大し、知能が発達し始め、本格的に道具を作製し、積極的に狩りを行うようになりました。旧人類(ホモ・ハイデルベルゲンシス)は約60万年前に、アフリカで誕生して、手、脳、道具の相互作用が進み、さらに脳が大きくなり、中型や大型の動物の狩猟をするようになりました。新人類(ホモ・サピエンス)は約20万年前に、アフリカで誕生して、約6万年前に世界中に拡散し、約1万年前には農業や牧畜を始めました。
この進化において、人類が「火」で肉や植物食物を加熱調理することで、病原となる寄生虫や細菌が減少し、動物性タンパク質からの栄養摂取が容易になり、植物食物は結合が緩和され、デンプンの糖化が進み、ヒトの摂取カロリーが上昇し、脳の拡大が誘発されたと考えられています。
では、人類はいつから「火」を使い始めたのでしょうか? 多分、二足歩行をすることで、自由になった手で道具を使うようになり、火を利用するようになったと推測されます。
最初は火を起こすことができず、自然発火によって出火した山火事などの残り火を利用したものとみられます。その後、人類は火打石やキリモミ式発火などの発火法を発明して、火をコントロールする技術を獲得することで、火で肉食獣を遠ざけ、草原や林に火を放ち、罠や待ち伏せ場所に獲物を追い込んで狩猟を行い、火で暖をとり、明かりや料理にも使いました。さらに、炉が発明されると、いつでも火が利用できるようになり、集団生活で共有されるものとなり、炉を囲み食事や団らんを取ることでコミュニケーションが育まれ、社会性が発達しました。
考古学的に考証された世界最古の火を使った証拠は、イスラエルにある原人か旧人類による79万年~69万年前のゲシャー・ベノット・ヤーコブ遺跡で、焼けたオリーブ、大麦、ブドウの種や木、魚の骨や手斧、火打石が発見されました。また、火が日常的に広い範囲で使われるようになった証拠は、約12万5千年前の遺跡から見つかっています。
燃焼とは、燃料が光や熱を伴って、連続的に比較的激しく酸素と反応する酸化反応です。燃焼の解明は、古代ギリシアに生まれた哲学から始まったと考えられています。物が燃える原因として、古代ギリシアの哲学者ヘラクレイトス(紀元前540~480年)は、「火の原素」を考えました。この火の原素は、古代ギリシアの自然哲学においては、水・空気・土と並ぶ四大元素の一つと考えられていました。
その後16世紀に入ると、スイス人の医師パラケルスス(1493~1541年)は、中世アラビアの錬金術師によって作り上げられた理論を発展させ、「硫黄・水銀・塩が燃焼すると、硫黄は消滅し、水銀は蒸発し、塩は灰として残る」という三原理説を唱えました。
1669年、ドイツ人の科学者ヨハン・ベッヒャー(1635~1682年)は、この四大元素説と三原理説を取り入れ、「すべての物質は空気・水・三つの土から成る」という説を唱えました。三つの土とは、石の土、燃える土、流動土であり、三原理説の塩・硫黄・水銀に対応し、「燃える土」が他の物質と分離する現象が燃焼であり、燃焼後に残る灰は「流動土」であり、加熱した時に物体が溶融するのは「石の土」の影響であると説明し、後にフロギストン説の起源となりました。
1697年、ドイツ人の医師ゲオルク・エルンスト・シュタール(1659~1734年)は、著書「化学の基礎」で、ベッヒャーの提唱した「燃える土」を燃焼をつかさどる元素として、ギリシア語の「燃える」という単語に由来する「フロギストン」と命名しました。「金属は灰とフロギストンが結合した状態で、木灰と金属灰を燃焼させることにより木灰のフロギストンが金属灰へ移る」と燃焼理論を説明しました。このフロギストン説は1750年代以降になると、科学界に広く受け入れられるようになりました。
しかし、金属を燃焼するとフロギストンが金属から離れるのであるから、質量はその分だけ軽くなるはずですが、燃焼した金属は逆に質量が増すという現象が16世紀に確認されました。1630年、フランス人の医師ジャン・レイ(1583~1645年)がスズを燃焼させると質量が増加することを発見し、1673年、アイルランド人の自然哲学者ロバート・ボイル(1627~1691年)もこの現象を確認しました。ボイルは、発生した熱の一部が金属に付着するため重くなるのではないかと考えました。その後、シュタールの死後には、「フロギストンが負の質量をもっている」という考えが主流になりました。
イギリス人の牧師で自然哲学者のジョゼフ・プリーストリー(1733~1804年)は、気相の酸素の単離に成功したことから一般に酸素の発見者とされていますが、彼自身がフロギストン説に固執し、化学改革(当時の新化学派が提唱した、多様化した物質の名前を一つに固定することを目的にした、物質の組成だけに基づいた体系的命名法)を拒否したために、科学界で孤立することになりました。1774年、彼は酸化第二水銀を太陽光で加熱すると、「2HgO→2Hg+O2」の反応よって、得られる気体が燃焼を激しくすることと、その気体の中でネズミが長生きすることを発見し、「脱フロギストン空気」と命名しました。
スウェーデン人の薬剤師カール・ヴェルヘルム・シェーレ(1742~1786年)は、軟マンガン鉱を濃硫酸に溶かし、加熱して発生した気体をロウソクの火に吹き付けると明るく輝くことを発見し、「火の空気」と命名しました。また、酸化第二水銀や硝石の加熱によっても「火の空気」が発生することを発見しました。1773年、彼はこれらの実験結果から、熱は「火の空気」とフロギストンからなり、酸化第二水銀の加熱実験は熱によって「火の空気」が追い出される現象であると考えました。さらに、彼は水素と酸素の燃焼実験で「火の空気」が空気全体の約1/5の体積を占め、空気の主成分が「火の空気」ともう一種類の気体(窒素)であることも発見しました。しかし、論文の発表が1777年とジョゼフ・プリーストリーが王立協会へ論文提出した1775年より遅かったので、化学史的に酸素の発見者はジョゼフ・プリーストリーとされました。
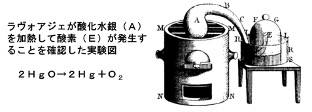
近代化学の父と称されるフランス人の化学者アントワーヌ・ラヴォアジエ(1743~1794年)は、1774年に体積と重量を精密にはかる定量実験を行い、化学反応の前後では質量は変化しないという質量保存の法則を発見しました。そして、金属を加熱して金属灰にすると重量が増すのは、空気が燃焼物に吸収されることによると考え、プリーストリーが「脱フロギストン空気」、シェーレが「火の空気」と呼んだ空気中の気体を「酸をつくるもの」という意味のギリシア語から、「酸素」と名付けて、シュタールが提唱した「燃焼は一種の分解現象でありフロギストンが飛び出すことで熱や炎が発生する(金属→金属灰+フロギストン)」というフロギストン説を退け、燃焼を「酸素との結合(金属+酸素→金属灰)」として説明し、燃焼理論を提唱しました。しかし、イギリス人の自然哲学者ヘンリー・キャヴェンディッシュ(1731~1810年)が1766年の論文で発表した、金属と強酸の反応によって水素が発生する現象を説明できませんでした。その後、1781年にプリーストリーが、水素と空気を電気発火で爆発させた反応で水が生成することを発見したことで、ラヴォアジエはこの現象を、水は今まで考えられていたような単一の元素ではなく、酸素と水素の二つの気体から成るととらえ、水素が空気中の酸素と結合することによって水が生成したと解釈しました。その後、ラヴォアジエの理論と比較してフロギストン説では、新しく発見される実験結果に対応するのが次第に困難になっていったために、化学者たちに見切りをつけられ、フロギストン説は衰退していきました。
ところで、燃料は燃焼反応の支燃物です。人類は火を利用し始めてから長いあいだ、おもに木および木炭を燃料にしてきました。しかし、鍛冶、染物、陶器、ガラス、レンガなどの工業で使用される燃料の需要が高まると深刻な木材不足が起こるようになりました。12~13世紀にはイギリスやドイツで石炭の本格的な採炭が始まり、さらにはコークスを使う近代製鉄が始まると石炭の消費が飛躍的に増大し、これが産業革命の原動力になりました。さらに、1765年、イギリス人の発明家ジェームズ・ワット(1736~1818年)による蒸気機関の改良は画期的で、石炭は蒸気をつくるための燃料の主流となりました。
有史以来、木や木炭から石炭への転換は、「第一次エネルギー革命」と呼ばれています。石炭は、水素、炭素、酸素、窒素、硫黄などの元素によって構成されている有機質の高分子であるために、石炭を燃やすと大気汚染の原因となる窒素酸化物(NOX)や硫黄酸化物(SOX)が発生します。そこで、石炭を蒸し焼きにして作ったコークスが大量に使用されるようになりました。この時に副次的に生産される石炭ガスが19世紀の照明の花形になったガス灯の燃料になりました。当時、欧米の照明の燃料には鯨油や獣脂、蜜蝋から作られるロウソクが用いられていましたが、安価なガス照明で産業界は夜間の労働を確保できるようになりました。1812年、ロンドンにガス照明を目的にしたガス会社が設立されると、石炭ガスが各家庭までパイプで運ばれるようになりました。その後、ガス会社がたくさん設立され、1850年頃の欧米の主要都市のほとんどにガス灯が普及しました。
やがて、電力による白熱灯とモーターの時代がおとずれると、照明用や動力用の石炭ガスは電力に置き換わりましたが、燃料用としての用途は残り、都市ガス事業は熱エネルギーを供給する事業へと変貌し大きく発展しました。さらにガス成分は、石炭ガスから、大気汚染物質を出しにくく、供給の安定性が高い天然ガスに変更されました。しかし、肝心の発電は、石炭、石油、天然ガスの燃焼で、高温・高圧の水蒸気を発生させてタービンに送り、発電機を回す火力発電が主力でした。
第二次世界大戦後、中東の豊富な石油資源が開発されました。1940年代以降、タンカーの大型化やパイプラインによる長距離大量輸送が可能になり輸送コストが低下し、様々な製品をつくる石油化学工業の原料が石炭から石油に置き換わりました。これを「第二次エネルギー革命」と呼びます。一般には、固体の石炭から液体や気体といった流体である石油や天然ガスへ転換したことから「エネルギーの流体化」とも呼ばれ、第一次・二次エネルギー革命をまとめて「エネルギー革命」とも呼びます。
天然ガスは、メタン(CH4)を主成分とするために、石炭、石油、LPガスに比較して、同じ熱量を発生させるときの二酸化炭素排出量や大気汚染の原因になる窒素酸化物(NOX)の排出量が少なく、硫黄酸化物(SOX)を全く排出しないために、クリーンなエネルギーとして、石炭、石油、LPガスからエネルギーシフトされることが期待されています。
さらに今後のエネルギーとして期待されているのが、燃焼時に二酸化炭素を排出しないで、水蒸気のみを排出する水素エネルギーです。しかし、水素は液化しにくい気体なので「水素の積載量」が課題になっています。一部燃料電池が家庭用や自動車用、定置用に実用化されていますが、コストが高く、汎用化するためには、多くの課題を解決する必要があります。
さらに、水から水素をつくる時に、大きなエネルギーが必要になるため、化石燃料に頼らない、太陽光や風力、地熱、海流などの再生可能エネルギーや原子力を用いない限り、結果的に二酸化炭素の排出量が多くなってしまいます。ますます進む地球温暖化を解決するためには、脱原発を念頭に、化石燃料から水素エネルギーや再生可能エネルギーへシフトすることが求められていますが、まだまだ多くの課題を解決していく必要があります。
文献:
ウィキペディア・フリー百科事典
「初期のひと属による火の利用」「猿人」「原人」「旧人類」「新人類」「フロギストン説」「ヘラクレイトス」「Paracelsus」「ヨハン・ベッヒャー」「ゲオルク・エルンスト・シュタール」「ジャン・レイ」
「ロバート・ボイル」「ジョゼフ・プリーストリー」「カール・ヴェルヘルム・シェーレ」
「アントワーヌ・ラヴォアジエ」「ヘンリー・キャヴェンディッシュ」「ジェームズ・ワット」
「石炭(利用の歴史)」「石油(歴史)」「液化石油ガス」「天然ガス」
パラケルスス( https://philosophy.hix05.com/Renaissance/renaissance08.paracelsus.html)
2023年3月2日
「化学の泉」投稿文(その14)/豆知識(はじまりシリーズ)
【周期表の歴史】
周期表は、物質を構成する基本単位である元素を、それぞれが持つ物理的または化学的性質が似たもの同士が並ぶように決められた規則(周期律)に従って配列した表です。
18世紀のイタリア人物理学者アレッサンドロ・ボルタ(1745~1827年)の電池による電気分解や、1802年にイギリス人の化学者で物理学者のウィリアム・ウォラストン(1766~1828年)により、太陽光のスペクトルのなかに太陽の元素により吸収されてできる暗線(フラウンホーファー線)が発見されたことで発展した分光分析法などによって、新しい元素が続々と発見されました。
特に分光分析法は、ある元素だけからできた純粋な物質がなくても、元素が含まれている物質が少量でも存在すれば、元素を分析できる画期的なものでした。物質を炎の中で加熱して、そのときの光をプリズムが入った分光器に通すと、光が波長の違いによって分かれてできるスペクトルは、元素ごとにまるで指紋のように異なり、とびとびの波長の光だけが光る輝線と、その間の暗線を観察することができたからです。このような化学の発展に伴い、18世紀後半から19世紀前半にかけて数多くの元素が発見されました。
1789年に質量保存の法則を発見し、酸素を命名し、「近代化学の父」と称されたフランス人化学者アントワーヌ・ラヴォアジエ(1743~1794年)が作成した元素表では、33個の元素が記載されていましたが、1830年までにその数は55にまで増え、それとともに化学者の中には、漠然とした不安が持ち上がっていました。それは、「元素は一体何種類あるのか、そしてこの増えるばかりの元素には何かしらの法則性が隠されていないだろうか」という疑念でした。
1829年、ドイツ人化学者ヨハン・デーベライナー(1780~1849年)は1826年に発見された臭素の色や反応における性質、そして原子量が塩素とヨウ素の中間にあることに気づき、同様の組み合わせが無いか研究して、「カルシウム→ストロンチウム→バリウム」と「硫黄→セレン→テルル」にも同じような性質の近似性があることを見つけ、この組み合わせを三つ組元素と名付けました。しかし当時は原子量と分子量、そして化学当量が明確に区分されていなかったために混同も多かったので、多くの化学者は単なる偶然と片付けてしまいました。
1862年、フランス人鉱物学者ベギエ・ド・シャンクルトワ(1820~1886年)が円筒状の紙に元素を螺旋型に並べると垂直方向に性質が近似した元素が並ぶ「地のらせん」という説を発表しましたが、数学における錬金術的な「数秘学」という方法で説明し、的確な図を添付しなかったので、他の科学者には理解されませんでした。
1864年、イギリス人化学者ジョン・ニューランズ(1837~1898年)が当時知られていた元素を並べると、最初の水素と8番目のフッ素の性質が似ており、以下2番目のリチウムと9番目のナトリウムも同じ傾向があり、7番目の酸素と14番目の硫黄まで同様の傾向がみられることから、音楽の音符になぞらえて「オクターブ(8音階)の法則」と名付けて提唱しましたが、当時は荒唐無稽だと笑いものにされてしまいました。
1870年、ロシア人化学者ドミトリー・メンデレーエフ(1834~1907年)は化学の教科書を執筆している際に、発見済みの数が63個にまで増えていた元素を説明する方法に悩み、自分が好きなカードゲームから発案して、元素名を書き込んだカードを原子量順に並べ替えることを何度も繰り返すうちに、原子価を重視し、かつ適切に当てはめられる元素が表中に無い場合には、「エカ・ホウ素」「エカ・アルミニウム」「エカ・ケイ素」などの仮の名をつけて元素を割り当てずに空けておくという工夫を施した周期表をドイツの科学雑誌に発表しました。ドイツ人化学者ロータル・マイヤー(1830~1895年)はこれに注目し、原子容(単体1モルが固体のときに占める体積)の考え方を加えた論文を発表しました。メンデレーエフはマイヤーの論文を参照し、ローマ数字ⅠからⅧで縦の分類を施し、うちⅠ~Ⅶを基本的に1~2族および13~17族に対応させ、Ⅷには遷移元素群を入れ、また貴ガスは反映させず、それぞれには2種類の亜族を設け、表の左右に振り分けて区分した、改良を加えた第二周期表を提唱しました。
メンデレーエフの周期表はすぐに認められませんでしたが、1875年、フランス人化学者ポール・ボアボードラン(1838~1912年)が分光分析法で新元素ガリウムを発見し、これがメンデレーエフの周期表中の「エカ・アルミニウム」と一致した性質を持つことが判明すると、この周期表が注目を浴びるようになり、1886年に発見されたゲルマニウムが「エカ・ケイ素」の空白の位置を埋めるものだということが判明し、この周期表による予想の正しさが証明されました。これに伴い、「オクターブの法則」のジョン・ニューランズも再評価されイギリス化学学会から賞を授与されました。
しかし、メンデレーエフの周期表の予言では収められないケースも出てきました。1794年、スウェーデンの小村イッテルビーで発見された鉱物群から多くの新元素が発見され、1907年までにその数は14にもなりました。これらは希土類元素と呼ばれ、いずれもよく似た性質を持っていました。1920年以降にこれら希土類元素はランタノイドという概念の下にまとめられました。
また、メンデレーエフの周期表は化合物の合成の観点から、原子価を重視して作成されましたが、1894年、イギリス人物理学者ジョン・ウィリアム・ストラット(1842~1919年)と化学者ウィリアム・ラムゼー(1852~1916年)は化合物をつくらない新元素を発見し、「怠け者」を意味する、アルゴンと命名しました。ラムゼーは化合物をつくらないアルゴンをどのように周期表に組み込むか、悩みましたが、1898年までに同様な性質を持つ、ヘリウム、ネオン、クリプトン、キセノンが相次いで発見され、これらを貴ガス類元素と呼んで、周期表の族の一種と考え、表の右端に置きました。後にラムゼーは「空気中の貴ガス類元素の発見と、周期表における位置決定」の功績によりノーベル化学賞を受賞しました。
周期律における位置は、陰イオンをつくりやすいハロゲン元素の次にイオンになりにくい貴ガス元素がきて、その次に陽イオンになりやすいアルカリ金属がくるという配置になり、周期表はより理解しやすいものになりました。
さらに1913年、デンマーク人理論物理学者ニールス・ボーア(1885~1962年)が提唱したボーアの原子模型で、元素は電子配置によって性質が左右し、その軌道が周期表の周期と対応していることが説明され、周期表で示される元素の性質を作り出す構造が理論的に説明されました。
1959年、アメリカ人量子化学者ライナス・ボーリング(1901~1994年)が同位体の存在を考慮し、「元素とは、原子核の陽子数で分けた原子の種類のことである」と「一般化学」という教科書で定義し、化学者のあいだで公知となりました。現在の周期表では、元素は原子量の順ではなく、原子番号(原子核の中の陽子の数)の順に並べられています。現在のところ元素は118種類が確認されています。
周期表は、錬金術師、化学者、物理学者、その他の科学者など、無数の人たちによる知の集大成です。元素の性質が簡潔かつ完成度が高く示された周期表は反応の分類や体系化および比較を行うための枠組みを与えるものとして「化学のバイブル」とも呼ばれています。そして、化学だけでなく物理学、生物学、化学工学を中心に工学全体に、多くの法則を示す表として用いられています。
文献:
ウィキペディア・フリー百科事典
「周期表」「アレッサンドロ・ボルタ」「ウィリアム・ウォラストン」「分光分析法」「アントワーヌ・ラヴォアジエ」「ヨハン・デーベライナー」「ベギエ・ド・シャンクルトワ」「ジョン・ニューランズ」「ドミトリー・メンデレーエフ」「ロータル・マイヤー」「ポール・ボアボードラン」「ジョン・ウィリアム・ストラット」「ウィリアム・ラムゼー」「ニールス・ボーア」「ライナス・ボーリング」
2023年2月4日
「化学の泉」投稿文(その13)/豆知識(はじまりシリーズ)
【原子論の歴史】
原子論とは、自然はそれ以上分割できない最小単位としての原子から成り立つとする理論や仮説です。
紀元前6世紀から紀元前4世紀にかけて古代ギリシアでは、芸術・思想・学問が見事に花を咲かせました。ギリシアの学者の多くは哲学者と呼ばれ、天体の位置を精密にはかることができたり、幾何学の知識を利用して土地の測量ができたりする者がいました。彼らは、実験という科学の方法をもっていないまでも、自然界で起こる変化を注意深く観察し、様々な問題を考えました。
古代ギリシア最古の哲学者であり、ギリシア七賢人の一人とされるタレス(紀元前624~546年)は、「すべてのモノは何からできているか?」という問題を最初に深く追求したパイオニアでした。彼は小アジア、ミレトスのフェニキア人の大貿易商人で、地中海を船で旅し、広い世界を見ていました。そして、すべての物質はただ一つのもと「水」からできていると考えました。「水は冷えると氷になり、温めると元に戻る、温められた水は水蒸気に変わり、冷えると水滴をつくる。川や海や地面の水は、水蒸気になって空に昇り、雲になる。雲から雨や雪が降る。水の変わり方はさまざまで、どんなに変化しても消えてなくならない。金属の変わり方も、生物の変わり方も、水の変わり方と同じではないか」と考えました。タレスの「水」がきっかけになり、数多くの学者が、何が万物の“もと(元素)”なのかについて、議論を重ねるようになりました。
トラキア地方のアブデラの哲学者デモクリトス(紀元前460~370年)は、師であるフェニキア人の哲学者レウキッポス(生没年不詳)と共に、「すべてのモノは何からできているか?」という問題に対して原子論を主張しました。彼は地中海周辺を旅して回り、風土も歴史も文化も違う国々の自然と人間を観察して歩き、諸外国の学問と技術を学び、「万物をつくる“もの”は無数の粒になっていて、一粒一粒は壊れることがない」と考えました。これ以上小さな粒にすることができない一粒をギリシア語の「壊れない物」から「アトム(原子)」と名付けました。さらに「空虚(空っぽな空間)」について考え、「ケノス(真空)」と名付けました。アトム(原子)が空間である位置を占めたり、動き回るためには「ケノス(真空)」がなくてはならないと考えたからです。彼は「万物は原子と真空からできていて、その他には何もない」と考え、そして「無数の原子は、原子以外はない空っぽの空間の中で激しく絶え間なく動き回り、ぶつかり合っては渦をつくり、ある原子は、別のいくつかの原子とくっつき合って、一つの塊になりその塊が、いつしか壊れて、元のバラバラの原子に戻る。原子の並び方や組み合わせを変えれば、異なる種類の物質をつくることができる。万物は原子が組み合わさることで作られていて、“火、空気、水、土”も例外ではない」と考えました。
シチリア島のアクラガスの哲学者エンペドクレス(紀元前490~430年)は、タレスのように万物の“もと(元素)”をたった一つと限定するのは無理があると考えました。彼は、万物の“もと(元素)”を、「火・空気・水・土」の四つに設定し、「画家が絵の具を混ぜるように、四元素の混合によって自然のすべてのモノが作られる」と考え、「火・空気・水・土」の一つひとつは、タレスが考えたように「不生・不滅」で、休むことなく姿を変え、いつかは元に戻る元素だと考えました。
ソクラテスやプラトンとともに、西洋最大の哲学者の一人とされるアリストテレス(紀元前384~322年)は、エンペドクレスの考えを引き継ぎ、「元素はただ一種類の第一物質(さまざまな“もと”の、そのまた“もと”)しかない。この元素は、“火・空気・水・土”の四つの形をとり、“熱・冷・乾き・湿り”の性質の組み合わせによって、互いに変化する」と唱えました。「鍋に水を入れて火にかけると、火の性質の一つの『熱』は、水の性質の一つである『湿り』と一緒になり、“第一物質”は『熱』と『湿り』を受けとって『空気(湯気)』になって立ち上がる。水が蒸発してしまうと、火の性質の『乾き』と水の性質の『冷』と一緒になり、『土(ミネラル成分)』になる」としました。アリストテレスはデモクリストの原子論を「どんなモノも打ち砕けば小さな粒になる。壊れることのない粒なんてありえない。また、真空が存在するはずがない。見たところ空っぽの空間にも何かが詰まっている」と批判しました。アリストテレスの四元素説は、直感的に理解しやすく、また、彼がアレクサンドロス大王の家庭教師であり、あらゆる分野について本を書き、多くの弟子を育てており、その影響力は絶大で、当時の学者の間で「アリストテレスのいうことならば間違いはない」という「機運」がたかまり、アリストテレスの四元素説が19世紀のヨーロッパまで影響を与えました。原子論を支える「真空」の存在は、アリストテレスの「自然は真空を嫌う」の一言で一蹴されました。
ところで、鉱石の採掘では手押しポンプで地下水をくみ出すとき、深さが約10メートルを超えると水をポンプでくみ出せなくなってしまいます。この問題を解決したのは、近代科学・天文学の父と呼ばれたイタリア人自然哲学者ガリレオ・ガリレイ(1564~1642年)の弟子だったイタリア人物理学者エヴァンジェリスタ・トリチェリ(1608~1647年)でした。師であるガリレオが空気に重さがあることを実験で確かめていましたが、彼は水がポンプでくみ上げられるのは、空気の重さによって生じる大気圧で押されているからだと考えました。1643年、彼は水の柱の代わりに、同じ体積で水よりも13.6倍も重い水銀を使って実験をしました。一端を閉じたガラス管に水銀を満たし、閉じている端を上に立て、ガラス管の水銀が液面から約76センチメートルの高さにストンと落ちることを確認し、一気圧で支えられる水銀の高さが76センチメートルであることと、ガラス管の上部に出来た空間にはもともと水銀があったので、空気の無い「真空」ができたことを証明しました。さらに、1647年にフランス人の物理学者プレーズ・パスカル(1623~1662年)は、長いガラス管と水で同じ実験を行い、水だと一気圧で約10メートルの高さが支えられることを証明しました。これら、実験による真空の証明で、17世紀のヨーロッパでは、次第に「原子論」が受け入れられるようになりました。たとえば、アイルランド人自然哲学者ロバート・ボイル(1627~1691年)は、1661年に「物は小さくて硬い、物理的に分割できない微粒子からできている。」とする微粒子論を考えました。様々な化学反応が微小な粒子の運動によって起こると考えた方が、アリストテレスの四元素説よりも妥当であると考えたからでした。
18世紀の科学の世界における大きな謎の一つに「密度が異なる酸素と窒素が、高度が違っても同じように混ざり合うのはなぜか?」がありました。普通に考えれば、大気の底部には密度の大きな酸素が、その上にそれより密度が小さい窒素が層をつくるはずです。イギリス人の化学者で物理学者のジョン・ドルトン(1766~1844年)は、二種類の気体を混ぜると、それぞれの気体の原子の大きさが異なるために密着して静止することができずに拡散し、ついには均質な混合気体になってしまうと考え、「原子はその種類に応じて決まった大きさを持つ」という仮説を立てました。さらに、一番軽い気体である水素ガスの水素原子の質量を「1」として、知りたい原子が水素原子の何倍の重さがあるかを考えました。たとえば、「水」は、水素と酸素の質量比は1対8になり、水素原子と酸素原子が決まった割合で結びついている。このことから、彼は、二つの元素からできた数種の化合物をつくる場合、一つの元素に対する他の元素の質量は互いに整数比にあるという「倍数組成の法則」を発見しました。ドルトンの原子論は、古代ギリシアの原子論を復活させ、さらに発展させました。しかし、彼が原子量を正しく求めることができなかったために、その後百年の長きにわたって原子量の探求が繰り広げられました。
「水素ガスや酸素ガスの分子は、“H”、“O”なのか?“H2”、“O2”なのか?水の分子は“HO”なのか?“H2O”なのか?」このことがはっきりしないと正しく原子量を決めることができません。この問題を解決したのが、イタリア人の化学者で物理学者のアメデオ・アボガドロ(1776~1856年)でした。彼が、「水素、酸素などの気体は原子が二個結びついた分子からできている」という分子の概念を発表したことで、大きく進展しました。その後、「分子」は、「原子が結びついてできている物質の基本構造単位」となりました。このことから、原子量をもとに周期表がつくられ、原子論は多くの科学者に支持されましたが、原子や分子の存在は「仮説」に過ぎません。「原子・分子が存在するか?」は化学の大問題でした。
その問題を解決したのがドイツ人理論物理学者アルベルト・アインシュタイン(1879~1955年)が提唱した「ブラウン運動の理論」でした。1905年に「静止液体中に浮遊する小さな粒子における、熱の分子運動論から要求される運動について」という論文で発表され、微粒子の重さや大きさが異なると、微粒子が起こす不規則な運動の仕方が変わるという理論でした。その後、フランス人の物理学者ジャン・ペラン(1870~1942年)らが、ブラウン運動について精密な実験を行い、アインシュタインの水の分子が運動するという理論と計算結果が、見事に一致したことから、顕微鏡で観察できる微粒子のブラウン運動は、水の分子の激しい運動であることが証明されました。このことで、原子・分子の存在が科学者の間で信じられるようになりました。
19世紀末から20世紀にかけて「原子は、もうそれ以上細かく分けることができない、物質の一番小さい単位である」という自然科学の常識がひっくり返るような物理学上の新発見が続きました。まず1895年に、ドイツ人物理学者ヴィルヘルム・コンラート・レントゲン(1845~1923年)がエックス線を発見しました。これをきっかけに、1896年にフランス人の化学者で物理学者のアンリ・ベクレル(1852~1908年)が放射線を発見し、1898年にポーランド人の化学者で物理学者のマリー・キュリー(1867~1934年)らがトリウムを発見し、続けて放射性物質であるポロニウムとラジウムを発見しました。さらに、1900年には、ドイツ人物理学者マックス・プランク(1858~1947年)が量子論を、1905年にアインシュタインが特殊相対性理論を発表しました。
ポロニウムやラジウムなどの放射性元素の発見は、それ以上分割できない不生・不滅の粒子としてのアトム(原子)という旧来の知識を一新し、それまでの、「原子は決して壊れない物」という考えは否定されました。
1897年、イギリス人物理学者ジョゼフ・ジョン・トムソン(1856~1940年)が、真空放電の際にマイナス極から発生する「陰極線」の実験で、「電子」がすべての原子に共通して含まれていることを発見しました。1909年、核物理学の父と呼ばれたイギリス人の化学者で物理学者のアーネスト・ラザフォード(1871~1937年)とドイツ人物理学者ハンス・ガイガー(1882~1945年)の指導の下で、イギリス人物理学者アーネスト・マースデン(1889~1970年)が、真空中で鉛の塊の中にラジウムを入れ、一方向に向いた細い穴から「α粒子(ヘリウムの原子核)」を薄い金箔に向けて発射する実験を行い、大部分のα粒子が通り抜けることを確認しました。この実験結果からラザフォードは「原子が占める空間はスカスカで、中心にα粒子と反発する、プラス電荷を持つ原子核があり、原子核は原子全体と比べるととても小さい」ことを予想して、原子核のまわりを電子が回っている「原子模型」を提唱しました。その後、1932年、イギリス人物理学者ジェームズ・チャドウィック(1891~1974年)によって、原子核はプラス電荷を持つ陽子と、電気的に中性の中性子からなることが発見されました。そして、原子核に含まれる陽子の数は元素によって決まり、この数を「原子番号」と呼び、電子が極めて軽いために原子の質量は陽子と中性子の数で決まり、陽子と中性子の数の和を「質量数」と呼ぶようになりました。現在では、電子は波の性質が強く表れて、原子全体に広がって存在し、その存在確率に対応した濃淡のある「電子雲」が原子を取り巻いているモデルで表されています。
化学は物質の構造と性質および化学反応の三本柱で構成されています。物質の構造とは、物質の中でどのような原子がどのように結びついているか、それらがどのように立体的に配置されているのかを示します。原子論の確立や原子構造の探求で、化学反応の設計図がより確かなものになりました。そして、化学の知識は、工業や農業、医学など、すべての技術に応用されています。
文献:
ウィキペディア・フリー百科事典
「タレス」「デモクリトス」「エンペドクレス」「アリストテレス」「ガリレオ・ガリレイ」
「エヴァンジェリスタ・トリチェリ」「ロバート・ボイル」「ジョン・ドルトン」
「アメデオ・アボガドロ」「アルベルト・アインシュタイン」「ジャン・ペラン」
「ヴィルヘルム・コンラート・レントゲン」「アンリ・ベクレル」「マリー・キュリー」
「マックス・プランク」「ジョゼフ・ジョン・トムソン」「アーネスト・ラザフォード」
「ハンス・ガイガー」「アーネスト・マースデン」「ジェームズ・チャドウィック」
https//ja.eferrit.com/原子論の歴史/
2022年12月28日
「化学の泉」投稿文(その12)/豆知識(はじまりシリーズ)
【接着剤の歴史】
接着剤は物と物とをつなぐために使われる物質です。ISO(国際標準化機構)では接着を「接着剤を媒介とし、化学的もしくは物理的な力またはその両者によって二つの面が結合した状態」と定義しています。
接着は原子または分子が相互に拡散する溶接とは異なり、接合する界面が存在します。そのために接着力は被着材の表面状態に大きく左右されてしまい、事前に洗浄や研磨で異物を取り除く表面処理を施す必要があります。さらに接着剤が被着材の面全体を充分に濡らす必要があります。濡らすためには接着剤が初期に液体状またはそれに近い流体状になる必要があります。固体であっても熱や圧力などの外部作用により流動する状態に変化する必要があります。この流動性を持った接着剤が、接合しようとする被着材の面全体に塗布されていなければなりません。次に接着剤が硬化し、結合に必要な強度を持つことで接着が完成します。
接着の原理について、今のところ十分には解明されていませんが、接着のメカニズムには、「①機械的結合」や「②物理的相互作用」、「③化学的相互作用」があると考えられています。
① 機械的結合
アンカー効果とか投錨効果とも言われ、材料表面の孔や谷間に液状接着剤が入り込んで、そこで固まることによって接着が成立します。
② 物理的相互作用
分子間力(ファン・デル・ワールス力)を言い、二次結合力とも言って接着剤の基本原理とされています。
③ 化学的相互作用
一次結合力と言って最も強い接着力が期待される共有結合や水素結合を言います。この分子間力や原子間力が働くためには、物体どうしの距離が1億分の数cm以下ともいわれる分子レベルにまで接近していなければなりませんが、固体の物体の表面はミクロな目で見ると無数の凸凹があり、いくらぴったりと重ねても分子同士が引き合う距離まで近づくことはできません。接着剤はその凸凹にぴったり合うように変形して物体表面に密着することができるため、物体表面の分子と接着剤の分子との間に分子間力や原子間力が働くのです。
接着力とは、機械的な引っ掛かりや分子間力、原子間力によって成り立っていて、そのどれかに原因を絞り込むことができない複雑さを持っています。

接着剤の歴史は古く、人間が道具を使い始めたころに始まりました。石器時代には鏃(ヤジリ)を木の枝や竹に固定するために天然アスファルトが使われました。また、漆を使って修理された約6000年前の土器が見つかっています。石油資源が豊富な中近東では天然アスファルトが壁画制作や建築に利用されました。古代バビロニアでは彫像の眼を固定するためにアスファルトが使われました。紀元前2700年ごろのメソポタミアの古代都市ウル(現在のイラク南部)の王墓からは、天然アスファルトで貝殻や宝石を貼ったモザイク画「ウルのスタンダード(大英博物館 所蔵)」が発掘されています。旧約聖書にはバベルの塔のレンガの接着や、ノアの箱舟の防水処理用にアスファルトが使われたと記載されています。
東西を問わず古くから、漆喰がアスファルトと同じように建築材料の接着剤として、石垣や煉瓦建築によく用いられていました。漆喰は水酸化カルシウム(消石灰)や炭酸カルシウム(石灰岩や大理石)に砂を混ぜて、水を加えながら練り上げたもので、古代メソポタミア、古代ギリシア、古代ローマのいずれの遺跡でも発見されています。日本の漆喰は水酸化カルシウムに骨材、すさ(麻)、海藻糊などの有機物を練り混ぜたもので、古くは約4000年前の縄文時代後期の遺跡から発見されています。また城郭や寺社、土蔵などで、土塀に防水性や不燃性を付与する外部保護材料としても利用されました。
狩猟が盛んなエジプト、中国、ヨーロッパなどでは膠(ニカワ)が利用されました。膠はゼラチンを主成分とする接着剤で、5000年以上前の古代から利用されていました。獣類の皮や骨、腸、爪などを煮出した液を分離・冷却し、さらに乾燥させて作ります。乾燥させたものを水につけてから加熱して溶かすと接着剤になります。古代エジプトでは膠が棺や家具、パピルスなどを接着するために広く使われました。ツタンカーメンの墓からは膠を使った家具や宝石箱が出土しています。12世紀のモンゴルで作られた高性能の弓は、動物の骨を薄く削った板を数枚重ねて膠で接着したものです。
肉食の習慣が少なかった日本では、漆(ウルシ)や米などを原料としたデンプン糊が主に利用されていました。漆はウルシの木から採取した樹液で、ウルシオールを主成分とする天然樹脂塗料であり接着剤です。とりわけ日本の漆器はその高い品質により中世の頃から南蛮貿易を介して世界中に輸出されていました。また、稲作文化圏に属する日本では、米を蒸して、押しつぶしたデンプン糊が、寝殿造りで使われた襖や障子を作る時に接着剤として利用されました。
接着剤の大量生産は、18世紀のオランダに建設された膠(ニカワ)製造工場によって始まったと言われています。それ以降、天然ゴム、デンプン、カゼイン(牛乳に含まれるリン酸化タンパク質)などの天然系接着剤が、各国で製造されるようになりました。
さらに、天然素材を原料としない合成接着剤が誕生したのは今から100年ほど前のことです。19世紀後半から20世紀初頭にかけて、おもに石炭を原料に、さまざまな物質が人工的に合成されるようになりました。そのひとつが合成樹脂で、1872年、合成染料のインディゴ(藍色の染料)を合成したドイツ人化学者アドルフ・フォン・バイヤー(1835~1917年)が、石炭から得られるフェノールとホルマリンを反応させてできるフェノール樹脂を発見し、後に、1909年、ベルギー生まれのアメリカ人化学者レオ・ヘンドリック・ベークランド(1863~1944年)が、「ベークライト」と名づけて工業化しました。この物質は、電話、電灯、ラジオ等の電子部品として、また食器や灰皿などの日用品として、広く使用されたほか、熱を加えて固まるという性質から1915年に積層板製造時に接着剤として使用されたことを皮切りに、その後もさまざまなプラスチックの開発が続いたなか、軟らかくなったり固まったりする性質をもつ、ユリア樹脂(尿素樹脂)、メラミン樹脂、酢酸ビニル樹脂、アクリル樹脂、ポリアミド樹脂・・・、等が接着剤の素材に用いられるようになりました。
そして現在、身近な家庭用としては、木工・紙接着用途として事務用液体のりで馴染み深く、俗に言う洗濯糊としても知られているポリビニルアルコール系接着剤、紙接着や繊維・木工・合板用などに使われ、市販の木工ボンドとしてなじみ深い酢酸ビニル樹脂エマルジョン接着剤、金属・ガラス・陶器等の接着に適したエポキシ樹脂系接着剤、ゴム・金属やプラスチック類の、いわゆる瞬間接着剤として知られているシアノアクリレート系接着剤、などが使われています。一方、産業用としては、木材・金属・ガラスなど多様な被着材に対して高い接着力を持ち、船舶用やコンクリートパネルなどの用途に使われる、前述のフェノール樹脂系接着剤、エポキシ樹脂系接着剤のほか、耐久性に優れるため構造用接着剤の一つにも挙げられる、電気電子機器・車両・建築・金属など多くの分野で使われるアクリル樹脂系接着剤、耐候性・耐油性・耐寒性に優れ、金属・セラミック・プラスチックなどの構造材料用として、また食品包装用のラミネートフィルムの接着に用いられるウレタン樹脂系接着剤、硬化後にゴム弾性を有する、ガラス接着、電子・電気用、建築用などに使用されるシリコーン系接着剤などが、それぞれの目的に合わせて活用されています。
参考資料:
ウィキペディア・フリー百科事典
「接着剤(接着剤の歴史、接着剤成分の種類)」「アスファルト(歴史)」「漆(ウルシにまつわる歴史・伝承)」
「ゼラチン(膠、歴史)」「デンプン」「分子間力」「漆喰」「アドルフ・フォン・バイヤー」「レオ・ヘンドリック・ベークランド」
「接着剤(ポリビニルアルコール系接着剤)」「接着剤(酢酸ビニル樹脂エマルジョン接着剤)」「接着剤(エポキシ樹脂系接着剤)」
「接着剤(シアノアクリレート系接着剤)」「接着剤(フェノール樹脂系接着剤)」「接着剤(アクリル樹脂系接着剤)」
「接着剤(ウレタン樹脂系接着剤)」「接着剤(シリコーン系接着剤)」
コトバンク(https://kotobank.jp/word/投錨効果-137704)「投錨効果の解説」
マルヤ通商ホームページ(https://www.maruya-t.co.jp/topics/secchakuzai-1.htm)接着剤の基礎知識
日東電工(株)ホームページ(https://www.nitto.com/jp/ja/tapemuseum/history)接着剤の始まり
2022年12月1日
「化学の泉」投稿文(その11)/豆知識(はじまりシリーズ)
【合成香料の歴史】
香料は、様々な植物や一部の動物から抽出された天然香料、あるいは化学的に合成された合成香料を多数調合して作られます。これらはフレーバー、フレグランスに関わらず調合香料と呼ばれています。フレーバーとフレグランスの違いは「口に入るものかどうか」で判断されます。たとえば、歯磨き粉に使われる香料は口に入るものだからフレーバーです。一方、柔軟剤や香水などに用いられる香料は口に含むことはないので、フレグランスです。香料統計によると香料の国内シェアーの85%以上がフレーバーに使われています。
人工的に精製・製造された香料を合成香料と呼びます。狭義にはベンゼンやアセチレンなど基礎的な化学物質から製造されたものを指しますが、広義には精油などの天然物から蒸留・結晶化などの人工的操作により生成される単離香料も含まれます。
ヒトが「香り」を利用するようになったのは、人類が火打石やキリモミ式発火などの発火方法を発見し、炉が発明され、いつでも火が利用できるようになった時からだろうと言われています。
古くは、紀元前3000年頃のメソポタミアで、シュメール人がレバノンセダー「香りのする杉(ヒマラヤスギ属)」を薫香として神に捧げたことが記録とされています。香料をあらわす英語“perfume”は、ラテン語で「煙によって」という意味の“per fume”が語源です。
古代エジプトでは、王様が亡くなると、香料が持つ防腐・防臭効果を生かして、その亡骸に白檀(びゃくだん)、肉桂(にっけい)、イリス(アヤメの一種)の根や、香りのよい樹脂をたっぷりと塗り、ミイラにして手厚く葬りました。さらに、残された壁画には、部屋を芳香で満たし、香油を身体に塗り、衣類に薫香を焚き込み、日常生活で「香り」を楽しんでいた様子が描かれています。

古代ギリシャ時代になると、香料製造が盛んになり、入浴後に香油を体に塗る習慣が広まりました。
古代ローマ時代になると、美食文化を誇る貴族階級は、主力調味料の魚醤の生臭さを消すために香辛料やビネガーを用いました。さらに、浴室や寝室にまでローズウォーターなどの香りを用いるようになり、日常生活で香料を使用するようになりました。
キリスト教の勢力が強まった11~13世紀の中世盛期ヨーロッパでは、香料は贅沢で不道徳なものと考えられるようになり一時期、その使用が衰退しましたが、一方のイスラム圏では、植物の花、葉、根、枝、種子、樹皮、果実などを蒸留して精油(植物に含まれている芳香性の油)を抽出する方法が発明され、それをアルコールに溶かした、現在の香水の原型となるものがつくられました。
これらイスラム圏の香料や香水は、11~13世紀の十字軍遠征や15世紀の東西貿易の拡大によって、東洋からヨーロッパに伝わりました。
16世紀のヨーロッパでは、入浴の習慣がなかったために、上流階級を中心に、体臭をカバーする目的で香水が沢山使用されるようになり、イタリアやフランスでも香料が生産されるようになりました。
また同じ頃、皮革産業で栄えていた南フランスの町グラースでは、なめし革の臭みを消すために香料が用いられるようになりました。最初は、自生する植物を香料の原料にしていましたが、温暖な気候や優れた土質を活かして、原料となる香料植物の栽培を始めたのをきっかけに、本格的な香料工業がスタートしました。
19世紀になると、おもに石炭を原料に、さまざまな物質が人工的に合成されるようになりました。「クマリン」はシナモンの香り成分のシンナムアルデヒドやコーヒーの香り成分であるコーヒー酸とともに天然の香り成分として知られています。当初は中南米に育つマメ科のクマルという樹木から得られる種子(トンカ豆)から分離されていましたが、1876年、人工染料「モーブ」を発見したことでも有名なイギリス人化学者ウィルアム・パーキンが、石炭から得られるコールタールを原料にして、サルチルアルデヒドと無水酢酸の反応(パーキン反応)により「クマリン」を合成することに成功しました。
ヘリオトロープの花の芳香成分「バニリン」は、バニラ豆の製油に含まれているバニラの香りの主要な成分です。化学者達が物質の基本的な化学構造に注目し始めたなか、芳香成分の化学構造に関する研究が進められるなどした結果、1874年、ドイツ人化学者フェルディナント・ティーマンとヴェルヘルム・ハーマンにより、コニフェリンを原料として初めて合成されました。
ジャコウ鹿から取れるじゃ香「ムスク」の香りは、性フェロモンの一種で、人間でも特に女性がじゃ香の香りに敏感であることから、古来より珍重されてきました。1906年、ドイツ人化学者オットー・ヴァラッハはじゃ香の成分を単離し、組成式がC16H30Oでありケトンの化学構造を持つことを解明し、その化合物を「ムスクの香りがするケトン」から「ムスコン」と命名しました。ヴァラッハの研究チームによって、いろいろな精油に含まれる芳香成分の化学構造が解明されていくにつれ、より多くの芳香成分の合成が可能となり、1910年にヴァラッハは、それらの研究による化学工業への貢献が認められて、ノーベル化学賞を受賞しています。その後、ムスコンの構造解明の研究が行われ、1926年、スイス人化学者レーオポルト・ルジチカによってムスコンの正体が3-メチルシクロペンタデカノンであることが解明されました。ルジチカの研究チームはムスコンをはじめ、数々の天然にある芳香成分の構造を解明して、それらに代わるものの合成に成功し、この業績により、1936年にルジチカもノーベル化学賞を受賞しました。最終的に、ムスコンの人工合成は、1934年、ドイツ人化学者カール・チ-グラーによって達成されました。
その後、分析技術が著しく向上したことにより、それぞれの香料に含まれている一つひとつの芳香成分の種類、量、詳細な分子構造等が明らかになってきて、複数の芳香成分が組み合わさった複雑な香りも、合成によって再現することができるようになりました。また一方では、芳香成分の分子構造と香りの質の関係、濃度や組み合わせ等が及ぼす人間の臭覚の変化などに関する研究も行われています。そして今、私たちの身の回りでは、石油などを原料とした香料が、香水のほか、化粧品、芳香剤、さらに食品、飲料など、実に幅広く活用されています。
参考資料:
ウィキペディア・フリー百科事典
「香料」「合成香料」「クマリン」「ウィルアム・パーキン」「バニリン」
「フェルディナント・ティーマン」「ヴェルヘルム・ハーマン」「コニフェリン」「ムスク」
「オットー・ヴァラッハ」「レーオポルト・ルジチカ」「カール・チ-グラー」
日本香料工業会ホームページ(https://www.jffma-org>learning)「香料の歴史」
ケムステホームページ(https://www.chem-station.com)「香りの化学」
2022年11月4日
「化学の泉」投稿文(その10)/豆知識(はじまりシリーズ)
【合成染料の歴史】
着色に用いる粉末で水や油に溶けるものを染料と呼び、不溶のものを顔料と呼びます。古代から染料として様々な植物や動物から抽出した天然色素が用いられてきました。アカネ、アイ、ベニバナ、紫根などが古代から知られていた植物由来の染料です。イボニシ貝などから得られる貝紫やエンジムシから得られるコチニールは動物由来の染料です。これらの色素の多くは大量の天然物を処理してもわずかな量しか得られなかったために希少品であり、使用が限られていました。
貝紫はロイヤルパープルと呼ばれ、王者の紫を意味します。紀元前1600年ごろから古代地中海のフェニキアで、アッキガイ科の巻貝の粘液線から極わずかしか採ることが出来ない分泌物を染料として染物をはじめ、紀元前1000年ごろには非常に高価な特産物として輸出して経済的に繫栄しました。ローマ帝国のカエサルの紫のマントや女王クレオパトラの旗艦の帆がこの貝紫で染められていたことは有名です。英語で“born in the purple”というと、王族や貴族の家に生れることを指しますが、古くから紫色は、洋の東西を問わず、高貴の色とされてきました。貝紫で染められた物には「力が宿る」と信じられ、多くの権力者たちが禁色として、一般の人間の使用を禁じてきました。現在のように紫色を広く一般に使用できるようになったのは、石炭化学が発展し、人工的に染料を作りだすことが可能となったからです。
18世紀の産業革命以降、工業が大規模化することで燃料の消費量が増え、薪や木炭に使用する木材が不足したために、森林資源の回復が追い付かなくなるのではとの懸念から工業用燃料として石炭が注目され、盛んに利用されるようになりました。石炭から得られるコークスは鉄を製錬する際に、また石炭ガスはガス灯の燃料として用いられていました。ところが、それらを取り出した後に残るコールタールは、使い道がない上、臭くてネバネバして、捨て場にも困っていました。化学者達は何か良い利用方法は無いかと研究を続け、19世紀の半ばに、英国王立化学学校の教授でドイツ人化学者アウグスト・ヴェルヘルム・フォン・ホフマンが、コールタールからアニリンを抽出することに成功しました。一方、後に青色の染料インディゴを合成したドイツ人化学者アドルフ・フォン・バイヤーの師匠で、ホフマンの同僚でもあるドイツ人化学者フリードリヒ・アウグスト・ケクレは、物質の基本的な化学構造が明らかにされれば、偶然に頼ることなく、それぞれの原子がどのように結合できるかを予測した上で化学物質を合成することが可能になると考え、1865年に「ベンゼン環」を解明し、ケレクの理論を提唱しました。4本の腕を持つ炭素原子6個と、1本の腕を持つ水素原子6個が、亀の甲のように連なる化学構造は染料のみならず、さまざまな化学物質の基本構造となるもので、このケクレの理論に基づき、コールタールに含まれているさまざまな物質を用いて、次々に新しい染料が合成されるようになりました。
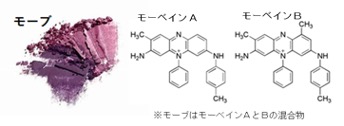
1856年、ホフマンのもとで助手を務めていたイギリス人化学者ウィリアム・パーキンがマラリアの特効薬であるキニーネの合成に取り組んでいましたが、キニーネを分解するとアニリンによく似た物質が出来ることから、逆にアニリンからキニーネを合成出来ないかと試しているうちに、偶然にもアニリンを二クロム酸カリウムで酸化し、その紫色の生成物が羊毛や絹を染色できることを発見しました。ゼニアオイ(フランス語で「モーブ」)の花の色に似ていることから「モーブ」と名付け、工業的な生産を開始しました。このモーブと名付けられた物質が世界初の合成染料でした。1862年、ロンドンで万国博覧会が開催された時には、ヴィクトリア女王がこのモーブで染めたドレスを着て出席し、ヨーロッパ中の話題になったそうです。
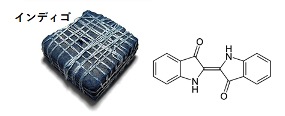
天然インディゴは染物や印刷に使われてきたもっとも古い染料の一つで、鮮やかな藍色を呈する染料です。天然インディゴの大部分は熱帯植物のコマツナギ属から得られます。いろいろな古代文明で知られていましたが、もっとも古い中心地はインドで、アラブの商人によって地中海に輸入された高級品でした。中世ヨーロッパでもインディゴは貴重品で、15世紀後半の大航海時代以降、ヨーロッパの列強国によって熱帯地方に多くのインディゴのプランテーションが作られました。
1878年、アドルフ・フォン・バイヤーは、植物の藍から採れる青色の染料インディゴにアニリンが含まれていることから、逆にアニリンからインディゴを合成できるのではないかと考えて、σニトロベンズアルデヒドとアセトンに水酸化ナトリウム、水酸化バリウム、またはアンモニアの希薄溶液を加える方法によって、インディゴの合成に成功しました。1897年にドイツのBASF社によって工業的合成法が開発され、1913年までには天然インディゴはほぼ合成インディゴにとってかわられました。
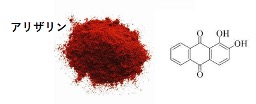
天然アリザリンはセイヨウアカネの根から採取される赤色の染料です。アカネは中央アジアやエジプトにおいて古代から染料として栽培されており、紀元前1500年ごろから、その製法が発達してきました。8世紀後半の中世ヨーロッパでは、フランク王国のカール大帝がアカネの栽培を推奨し、オランダの砂地で良く育ち、王国の経済を支えました。
1868年、ドイツBASF社のドイツ人化学者カール・グレーベとカール・リーバーマンがアントラセンを酸化してアントラキノンとし、スルホン化した後に水酸化ナトリウムでアルカリ融解してできたアリザリンナトリウムを還元して、アリザリンを合成しました。アリザリンは初めて合成された、天然物と同等な人工染料です。
現在製造されている合成染料は、ほとんどが天然染料にない構造のもので、優れた性能のものも多く、こうした染料合成化学の発展に伴い、染色を目的とした芳香族化学が確立しました。加えて、染色以外に、医薬、農薬の合成化学が発展してきたことは注目すべきことです。
合成染料は、私たちの身の回りの繊維や衣類にカラフルな彩りを添え、華やかさを演出してくれています。さらに、染めるという本来の目的に加え、光・熱・電気・圧力などのエネルギーにより消色・変色・発色する色素や、情報を記録する色素など、さまざまな機能を付与した色素が開発され、インクジェットプリンターのインク、レーザープリンターのトナー、プリクラ、光ディスクなど、身近な製品に実用化されています。
参考資料:
ウィキペディア・フリー百科事典
「顔料」「染料」「合成染料」「貝紫色」「モーブ」「インディゴ」「アリザリン」
「アウグスト・ヴェルヘルム・フォン・ホフマン」「フリードリヒ・アウグスト・ケクレ」
「ウィリアム・パーキン」「アドルフ・フォン・バイヤー」「カール・グレーベ」
「カール・リーバーマン」
2022年10月1日
「化学の泉」投稿文(その9)/豆知識(はじまりシリーズ)
【ゴム工業の歴史】
ゴム工業は天然ゴムや合成ゴムとそれらを主原料としたゴム製品を製造する工業です。
中南米のインディオたちはマヤ文明前期の6世紀ごろから、ゴム状の樹脂を出す植物から、樹液を集めて精製し、火であたためたり、煙でいぶしたりして、水分を蒸発させて凝固乾燥した「生ゴム」をつくっていました。土で作った型にゴムの樹液を塗って乾かし、中の土を砕いて取り出し、ゴムの壺や水筒をつくりました。足の型を取ってゴムの靴も作ったようです。7~10世紀のマヤ文明後期の遺跡には、球場の遺跡も多く残っています。芯までゴムで、バレーボールほどのボールを使い、神官のもとで球技が行われていたようです。手を使わず腰で跳ね返し、ボールを落としたほうが負けというものです。インディオたちはゴムをボールのほかにもいろいろな道具として使っていました。
近代人とゴムとの出会いは、1493年、イタリア人の探検家クリストファー・コロンブスの第2回航海でカリブ海の島に立ち寄った時にボール遊びしている原住民を見たことが始まりでした。地面に当たって大きく弾むゴムボールを見て非常に驚いたと伝えられています。その後200年余りの間、ヨーロッパにおいては、ゴムは不思議なものとして珍重されたものの実用化されることはありませんでした。
1736年に、フランス人の探検家シャルル=マリー・ド・ラ・コンダミーヌが地理観測のために南米の赤道地帯を訪れ、原住民がパラゴムノキの樹液から防水布やゴム靴などをつくっている様子を本国に報告してから、次第にゴムの実用化が進められました。1770年頃には、酸素の発見者で知られるイギリス人の自然哲学者ジョゼフ・プリーストリーが、ゴムでこすると鉛筆の字を消せることを発見し、消しゴムとしても使用されるようになりました。ちなみに、ゴムのことを英語で「ラバー(rubber)」というのは、「こする(rub)もの」という意味から来ています。19世紀に入ると、ゴムバンド、ガーター、ズボン吊りなどにもゴムが利用されるようになりましたが、当時のゴムはゴムの樹液を乾燥して固めただけの「生ゴム」で、すぐに伸びきってしまう上、寒い日には固くなってひび割れたり、また暑い日には軟らかくなってベトベトしたりと、欠点の多いものでした。
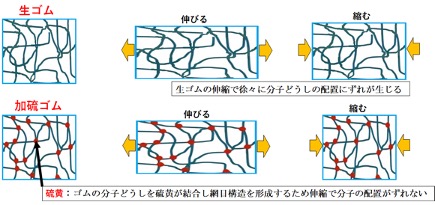 その改善策を発見したのが、ゴム工場でゴムの改良に取り組んでいたアメリカ人の発明家チャールズ・グッドイヤーで、1839年、ゴムに硫黄を混ぜた実験中に誤ってストーブに接触させたきっかけから、生ゴムに硫黄を混ぜて加熱すると、温度変化に強く、しかも自在に伸び縮みするゴムが得られることを発見し、その後実験を繰り返し、1844年に加硫ゴムの特許を取得しました。この新しいゴムは、イギリスの画家で発明家のウィリアム・ブロックドンの手に渡り、ローマ神話の火の神ヴァルカン(Vulcan)の名をとって「Vulcanized Rubber(加硫ゴム)」と名付けられました。そして、1843年、イギリス人の発明家トーマス・ハンコックが、加硫ゴムが伸びてもまた元通り縮むのは、硫黄によってゴムの分子どうしが結び付けられ、網目のような構造となるからだということを解明しました。また、加える硫黄の量を変えることにより固さや弾力が調整できることも分かり、これをきっかけに本格的なゴム工業が開花しました。ちなみに、ゴムの歴史を大きく変えた人物として、グッドイヤーの名前はアメリカのタイヤメーカーの社名に、またハンコックは「ゴム工業の父」として、今なお伝えられています。安定した弾力性と耐久性を兼ね備える加硫ゴムは、折からの産業革命により鉄道が普及すると、車両用バンパー耐振動吸収材として使われるようになりました。
その改善策を発見したのが、ゴム工場でゴムの改良に取り組んでいたアメリカ人の発明家チャールズ・グッドイヤーで、1839年、ゴムに硫黄を混ぜた実験中に誤ってストーブに接触させたきっかけから、生ゴムに硫黄を混ぜて加熱すると、温度変化に強く、しかも自在に伸び縮みするゴムが得られることを発見し、その後実験を繰り返し、1844年に加硫ゴムの特許を取得しました。この新しいゴムは、イギリスの画家で発明家のウィリアム・ブロックドンの手に渡り、ローマ神話の火の神ヴァルカン(Vulcan)の名をとって「Vulcanized Rubber(加硫ゴム)」と名付けられました。そして、1843年、イギリス人の発明家トーマス・ハンコックが、加硫ゴムが伸びてもまた元通り縮むのは、硫黄によってゴムの分子どうしが結び付けられ、網目のような構造となるからだということを解明しました。また、加える硫黄の量を変えることにより固さや弾力が調整できることも分かり、これをきっかけに本格的なゴム工業が開花しました。ちなみに、ゴムの歴史を大きく変えた人物として、グッドイヤーの名前はアメリカのタイヤメーカーの社名に、またハンコックは「ゴム工業の父」として、今なお伝えられています。安定した弾力性と耐久性を兼ね備える加硫ゴムは、折からの産業革命により鉄道が普及すると、車両用バンパー耐振動吸収材として使われるようになりました。
1850年~70年まで、イギリスはビクトリア王朝下で、世界の工場として君臨してきましたが、アメリカやドイツの追い上げにより、かげりがみえてきました。その結果、未開発国を征服して安価な原料を入手し、自国の経済を繫栄させる帝国主義の道を歩みだし、東南アジアの植民地で綿・コーヒー・茶・香料などで成功を修めていました。そんな中、アマゾン流域にしかなかった原料ゴムを移植する計画が持ち上がりました。生ゴムを世界的に独占するために、アマゾン流域の野生ゴムの種子をロンドンの王立植物園で発芽させ、東南アジアで、ゴム農園をつくるというものです。1876年、イギリス人の探検家ヘンリー・アレクサンダー・ウイッカムがそれに成功し、イギリスのインド省は1877年に発芽したゴムをセイロンに移植しました。ここを拠点にして、イギリス人の植物学者ヘンリー・ニコラス・リドリーが植物の成長する成形層を傷つけずにゴムの樹液を採るタッピング法をあみだし、良い苗木を育成する方法や接ぎ木などの増殖法を確立して、マレー半島各地に農園をつくっていきました。日本軍の東南アジア占領まで、イギリスは計画通り生ゴムを独占しました。
1888年、イギリス人の獣医で発明家のジョン・ボイド・ダンロップが自転車の空気入りタイヤを考案したのが今日のタイヤの基礎となりました。1880年代にガソリン自動車が発明されると、そのタイヤとしても急速に需要を拡大しました。
トーマス・ハンコックが加硫ゴムの網目構造を解明した1843年に前後して、1826年、イギリス人の化学者マイケル・ファラデーが天然ゴムの主成分がイソプレンであることを明らかにし、1860年イギリス人の分析化学者チャールズ・グレヴィル・ウィリアムスが天然ゴムを破壊蒸留によってイソプレンを単離し、構造単位であることを解明しました。さらに化学の進歩にともない天然ゴムがイソプレン「CH2=C(CH3)-CH=CH2」の重合体で、2つの二重結合が1つの単結合を挟んだ分子構造であることが解明されました。
19世紀後半に天然ゴムの生産地が東南アジアを中心とした地域に集まり、天候や戦争によってゴム資源が不足する国々が現れました。第一次世界大戦中、連合軍に封鎖されたドイツは1914年にジメチルブタジエンを原料にしてメチルゴムを製造しました。これが世界最初の工業化された合成ゴムです。第一次世界大戦後、1918年以降に増大したゴム需要から、天然ゴムに代わる人工のゴムの必要性がさらに高まり、合成ゴムの研究が進められました。1931年にアメリカのデュポン社の化学者ウォーレス・カロザースがイソプレン分子のメチル基を塩素原子で置換したクロロプレン「CH2=CCl-CH=CH2」を付加重合したクロロプレンゴムを開発し、翌年に工業化しました。また同年、ドイツでスチレンと1,3-ブタジエンの共重合で得られるスチレン・ブタジエンゴムが開発され、1934年にアメリカで工業化されました。このように石油から人工的にゴムを合成することが可能となり、耐薬品性、耐熱性、耐候性など、用途に応じてさまざまな特性をもつゴムがつくられるようになりました。そして現在では、ボール、ベルト、ホースなどの日用品から、医療用チューブ、人工筋肉等の医療分野、防音・防振床材、免震ゴム等の建築分野、さらに、高所や宇宙空間の低温にも耐えるタイヤやシーリング材等の航空・宇宙分野にいたるまで、実に幅広い分野に活用されています。
参考資料:
JRMA(一社)日本ゴム工業会ホームページ(https://www.rubber.or.jp)
富士ゴム化成(株)ホームページ(https://www.fujigom.co.jp)
コトバンク(https://kotobamk.jp/word/ゴム工業-66218)「ゴム工業の解説」
コトバンク(https://kotobamk.jp/word/天然ゴム-102665)「天然ゴムの解説」
コトバンク(https://kotobamk.jp/word/合成ゴム-62440)「合成ゴムの解説」
ウィキペディア・フリー百科事典
「ゴム(概念、歴史、種類、工業的利用)」、「クリストファー・コロンブス」
「シャルル=マリー・ド・ラ・コンダミーヌ」、「ジョゼフ・プリーストリー」
「チャールズ・グッドイヤー」、「William Brockedon」、「Thomas Hancock」
「Henry wickham」、「ヘンリー・ニコラス・リドリー」、「ジョン・ボイド・ダンロップ」
「マイケル・ファラデー」、「Charles Greville Williams」、「ウォーレス・カロザース」
2022年9月1日
「化学の泉」投稿文(その8)/豆知識(はじまりシリーズ)
【油脂工業の歴史】
油脂工業は、油脂や蝋を採取し加工・製造する化学工業です。油脂原料から油脂を取り出す製油工業と油脂を加工する油脂加工工業に分けられます。
油脂の起源は、すでに紀元前16世紀のモーゼの時代にオリーブ油が採取され、エジプトでもバターが採取されていたことが旧約聖書に記されています。また、古代ギリシアやローマの時代、民間療法の目的で脂が使用されていました。日本では4世紀中期、神功(じんぐう)皇后のころ、大阪住吉神社の灯明油としてイヌガヤの実を絞ったことが日本書紀に記されており、油脂の歴史は食用油よりも灯油から始まったとされています。
古く採油は、テコの原理を使った槓杆(こうかん)式加圧器やねじ式圧搾機などが用いられました。近世になると水圧式圧搾機やエキスペラー・プレスという搾油機が登場し、採油技術は進歩してきました。油脂は脂肪酸とグリセリンのエステルで、飽和脂肪酸が多く含まれる畜産動物の脂は常温で固体として存在するので、原料を加熱して油脂を溶出させる融出法で採取し、不飽和脂肪酸が多い植物油や魚油は常温で液体として存在するため、植物油は原料を加圧して油を絞り出す圧搾法と、アルコールなどの揮発性溶剤で油脂を溶出させる抽出法が用いられ、水産油脂は魚の煮汁から油を分離して採取します。製油工業では原料の種類や油の含有量、精製方法などを考慮して採集方法が選択されています。油脂が治療目的や民間信仰から灯用、食用を経て化学技術によって各種の油脂製品が生産されるようになると、人々の生活にとって油脂の重要性が急激に増していきました。
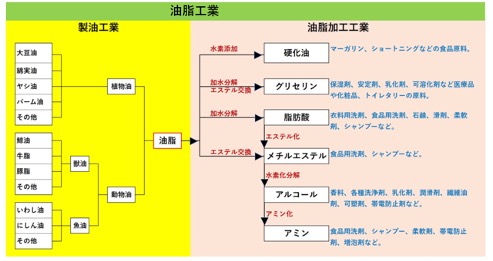 油脂加工工業は、油脂を原料に二次加工して脂肪酸、グリセリン、石鹸、硬化油などを製造します。
油脂加工工業は、油脂を原料に二次加工して脂肪酸、グリセリン、石鹸、硬化油などを製造します。
<石鹸、洗剤>
代表的な油脂加工品である石鹸は3千年前に存在し、ローマ時代の初期、サポーの丘でいけにえの羊を焼いて神に供えたとき、滴り落ちた脂が木灰(アルカリ)と混ざり合って石鹸の混合物ができたことに由来し、石鹸(soap)の名は地名のサポー(sapo)からきたと言われています。このように、石鹸は油脂をアルカリで加水分解処理(けん化)して得られる脂肪酸塩で、アルカリ性であり、アルカリ性に弱い羊毛や絹などの動物性繊維に使用できません。また、酸性の水やマグネシウムやカルシウムを多く含む硬水では洗浄効果を十分に発揮できません。
石油化学工業から得られる合成洗剤はこれらの欠点を克服して高い洗浄力を持ち、1960年代の電気洗濯機の普及とともに需要が拡大しました。石油化学工業からの合成洗剤などの界面活性剤を製造するものも含めて、油脂加工・石鹸・洗剤工業とも呼ばれます。
<油脂>
一般に「油脂」は、石油のような鉱物油や香水などの芳香性の油とは異なり、その成分に「グリセリン」を含んだものをいい、化学的成分からみると炭素、水素、酸素の3元素から成り立っています。一般的にグリセリンの性質は変わりませんが、脂肪酸はその分子構造に水素原子が多いか少ないかでそれぞれの性質が大きく異なります。分子中のC-C間に二重結合がない場合を「飽和状態」といい、この状態の脂肪酸を「飽和脂肪酸」といいます。一方、分子中のC-C間に二重結合が1つ以上ある場合を「不飽和状態」といい、この状態の脂肪酸を「不飽和脂肪酸」といいます。
油脂の主なものとしては、植物油では「大豆油、綿実油、パーム油、ヤシ油など」があり、動物油では魚油として「いわし油、にしん油など」獣油として「鯨油、牛脂、豚脂など」があります。主な脂肪酸について水素の飽和から不飽和状態の順に並べると、ステアリン酸(C=C「0」、牛脂)→オレイン酸(C=C「1」、オリーブ油)→リノール酸(C=C「2」、大豆油)→リノレン酸(C=C「3」、亜麻仁油)→クルパノドン酸(イワシ酸;C=C「5」、いわし油)となります。カッコ内のC=C「数字」は脂肪酸のC-C間の二重結合の数を示します。この水素原子が飽和している状態の油脂は不乾燥性でほぼ固体であり、水素原子が不足するにつれて乾燥度が強くなり液体に近づくとともに臭気が強くなります。いいかえると、油脂は脂肪酸分子中のC-C間に二重結合の減少につれて固体に近づくとともに臭気が減少します。飽和状態の牛脂の臭気がほとんどないのに対して魚油の臭気が強いのはこのためです。この原理を工業的に応用したのが硬化油工業です。硬化油製造は単に液体油を固形油脂に変えるだけでなく、魚油のような強い臭気を除去して純白な脂に変える一種の脱臭法でもあります。
液体油の主成分であるオレイン酸およびその他の不飽和脂肪酸の混合グリセリンに、ニッケル触媒で水素を添加すると、不飽和脂肪酸は“追加反応”により水素を吸収して飽和脂肪酸であるステアリン酸に変化します。硬化油製造の過程でこの飽和状態をコントロールし硬化の程度を自由に加減することができることから、様々な種類の油脂製品が生産可能になり、硬化油の用途が広がりました。
<硬化油>
硬化油の原料は、主原料が油脂で、副原料に水素および触媒を使用します。水素は、「①水の電解によるもの」、「②食塩の電解による苛性ソーダの副生水素を利用するもの」、「③加熱した鉄で水蒸気を分解する方法」などがあります。触媒はニッケルおよびその化合物が用いられています。
液体油を固形油脂に転化させて硬化油をつくる方法は理論的には19世紀末に確認されていましたが、それが経済的に可能になったのは20世紀に入ってからです。1897年、フランス人の化学者ポール・サバティエは触媒として微量のニッケルを使うと、アルケンなどのC-C間の二重結合を1個持つ炭素化合物(不飽和炭化水素)の分子に容易に水素を付加できることを発見しました。これが水素添加法の基礎になり、魚油などの液体油を固形の硬化油にすることが可能になりました。1902年、ドイツ人で「硬化油工業の創始者」と呼ばれる、化学者ヴェルヘルム・ノルマンが水素添加法の基礎に立って油脂を応用し、硬化油製造法を発明して特許を取得しました。1906年、イギリスのクロスフィールド・サンズ社がこの特許を譲り受けて、初めて硬化油を工業化しました。1913年、ドイツ人のフリッツ・ハーバーによって開発された空中窒素固定法によるアンモニアの合成がドイツBASF社の技術者カール・ボッシュによって工業化され、化学工業で水素が大量に使用されるようになりました。これを受けて、油脂工業においても水素の使用による硬化油の製造が本格的に工業化され、ヨーロッパで固形油脂(マーガリンや石鹸)の供給が盛んにおこなわれるようになりました。
<まとめ>
油脂はもともと、グリセリンと脂肪酸が結合したトリグリセライドと呼ばれる化合物です。そのため、加水分解すると脂肪酸とグリセリンに分けることができます。油脂を加水分解して得られる脂肪酸の誘導体である各種界面活性剤は、衣料用洗剤、食器用洗剤やシャンプーなどに利用されています。ステアリン酸などの脂肪酸はタイヤなどのゴム製品の滑剤として添加されるなど工業用に広く使用されています。脂肪の分解廃液を生成して得られるグリセリンは保湿剤、乳化剤などとして化粧品に利用されたり、エチレングリコールと同様に不凍液として使用されたり、ニトログリセリンの原料としても重要です。
油脂加工・石鹸・洗剤工業は、化学工業の中で重要な役割を果たしつつ、生産技術の近代化が進み、生産規模の拡大と品質の向上がはかられ、製品の多様化がどんどん進んでいます。
参考資料:
油脂工業会館ホームページ(https://www.yushikaikan.or.jp)
JCA日本石鹸洗剤工業会ホームページ(https://jsda.org/w/index.html/)
鈴木商店記念館ホームページ(https://www.suzukishoten-museum.com)
ポール・サバティエ(https://www.wikizero.com/ja/ポール・サバティエ)
コトバンク(https://kotobank.jp/word/油脂工業-145077)「油脂工業の解説」
ウィキペディア・フリー百科事典
「油脂工業」、「油脂」、「硬化油(概要、利用、製造)」、「脂肪酸」、「飽和脂肪酸」、「不飽和脂肪酸」
「グリセリン(利用、歴史)」、「ポール・サバティエ」、「ヴェルヘルム・ノルマン(経歴)」
「水素化(歴史)」
2022年8月2日
「化学の泉」投稿文(その7)/豆知識(はじまりシリーズ)
【化学繊維の歴史】
化学繊維は「化学処理を施した繊維、あるいは化学的手段によって作られた繊維」と定義されています。化学による化学組成の変化だけでなく、溶融など物理化学も含めた化学的手段によって作られた繊維を化学繊維として、天然繊維と分けられています。化学繊維工業には、綿花の短繊維や木材パルプを原料とするセルロース系化学繊維工業と、石油を原料とする合成繊維工業とがあり、天然の糸状高分子または合成高分子を繊維状にする工程が中心です。したがって、化学工業的性格と繊維工業的性格をあわせもっているのが大きな特色といえます。化学繊維工業は、人絹、スフ、アセテートなどのセルロース系化学繊維によって開始されましたが、石油化学工業の発展とともに、合成繊維の製造が中心となり今に至っています。
カイコの繭から採った動物繊維の絹は、独特の光沢と滑らかな質感を持ち、古来より珍重されています。絹糸は紀元前3000年頃に中国で生産が始まり、古代エジプトや古代ローマの上流階級に衣服として好まれ、シルクロードの時代には、同じ重さの金と交換されるほど貴重だったと言われ、非常に高価なものでした。また、絹糸のような繊維を人工的に作るのは化学者の長年の夢でした。
1855年にフランス人化学者イレール・ド・シャルドネは木材パルプから取り出した天然繊維であるセルロースを硝酸と硫酸の混合物を使用してニトロセルロースに変換して、揮発性の有機溶媒に溶かし、小さい孔から噴出させることで、溶媒を瞬時に蒸発させて、細い光沢ある繊維を作ることに成功しました。この世界初の化学繊維は光(ray)のように美しく輝く糸という意味で「レーヨン(Rayon)」と命名されて特許を取得し、パリ万博で発表してたいへん話題になりました。しかし、レーヨンは極めて燃えやすく危険で、レーヨンのドレスを着た人間が火だるまになるという事故が続出し、衣料品への実用化はかなえられませんでした。
1892年にイギリス人化学者エドワード・ジョン・ベヴァンとチャールズ・フレデリック・クロスが、天然のセルロース繊維を水酸化ナトリウムで処理した後に二硫化炭素を混合して赤褐色の粘性コロイドのビスコース(セルロースキサントゲン酸ナトリウム)を生成し、このビスコースを細い穴から希硫酸中に噴出させてセルロース分子に戻して高分子に再編成することで、セルロース繊維の分子の長さや形状を自在に再生できる製造方法(キサントゲートプロセス)を共同開発して特許を取得し、安全に加工されたビスコースレーヨンとセロファンを本格的に工業化しました。
1897年にドイツ人化学者マックス・フレンメリーとヨハン・ウルバンが、硫酸銅水溶液に水酸化ナトリウムを加えて生成した水酸化銅をアンモニア水溶液に溶解した濃い青色の溶液に天然セルロース繊維を溶解させて、細い穴から酸性の水中に押し出すことで、セルロースを再生させて繊維を再編成する製造方法を発明して、白熱電球のフィラメント用途に商業化しましたが売れずに失敗しました。その特許をドイツのJ・P・ベンベルク社が取得し、レーヨンより繊維の吸放湿性や耐久性、耐摩耗性に優れていたので銅アンモニアレーヨン(ベンベルク)として商業化して服地に広く使用されるようになりました。
「戦後、強くなったのは女性とストッキング」というフレーズが流行したことがありましたが、ストキッングが強くなったのは、ナイロンという化学繊維の発明があったからです。それ以前のストッキングに使用されていた絹は、しなやかな肌触りと美しい光沢を持つ半面、繊維としては弱く、また非常に高価なものでした。1935年に米国人化学者でデュポン社の有機化学部門のリーダーであったウォーレス・カロザースが世界初の合成繊維のナイロン6,6の合成に成功しました。ナイロン(nylon)の名称は「伝線(run)しないストッキング用の繊維」を意図した「norun」に由来しています。ナイロン6,6はアジピン酸とヘキサメチレンジアミンを重合して作られます。女性のストッキング用として使われたのが始まりで「石炭と水と空気から作られ、鋼鉄よりも強く、クモの糸より細い、絹のような肌触りと光沢を持つ」というのがナイロン発表のキャッチフレーズでした。カロザースは「高分子化学の創業者」と呼ばれたドイツ人化学者ヘルマン・シュタウディンガーが提唱した重合体の高分子説を実証するために高分子の研究に取り組みました。絹の主成分であるフィブロイン(タンパク質の一種)の化学構造「アミノ酸の分子が鎖のようにつながってひとつの長い分子(高分子)を作っている構造」に着目し、石炭から取れるジアミンとジカルボン酸をアミノ酸の代わりに使って、同じような構造のものをつくることを試み、10年近い歳月をかけて、さまざまな種類のジアミンとジカルボン酸の組み合わせによる合成実験を繰り返しジカルボン酸の一種であるアジピン酸を使って、ナイロン6,6を作ることに成功したのです。1938年に工業化され、その2年後の1940年にナイロン製ストッキングが発売されました。しかし、カロザース自身は悪化したうつ病のためか、ナイロンの商品化を見ることなく、1937年に青酸カリを混ぜたレモンジュースを飲んで自殺しました。
デュポン社は、1944年に触媒の存在下でプロピレンにアンモニアと酸素を作用させて生成したアクリロニトリルを溶剤に溶かしてノズルから押し出し紡糸する溶液紡糸法を開発し、ウールの特徴をまねたアクリル繊維を1950年から工業化しました。イギリスのキャリコプリンターズ社は、デュポン社のカロザースが1931年に開発した脂肪族ポリエステルをもとに研究開発を重ね、1942年にテレフタル酸とエチレングリコールを脱水縮合させてポリエステルのもとになるポリエチレンテレフタレートの合成に成功して、麻の特徴をまねたポリエステル繊維を1955年から工業化しました。ナイロンを皮切りに、次々に新しい合成繊維が開発され、化学繊維工業は石油化学工業の一部に組み込まれるようになりました。
1959年に米国のユニオン・カーバイド社の子会社ナショナル・カーボンがレーヨンを高熱で炭素化して黒鉛にする世界初の炭素繊維を発明しました。1970年代には有機繊維やピッチなどを重量比で90%以上炭素化処理して得られる炭素繊維が開発され、合成樹脂などと組み合わせて、軽量で高強度、耐熱性に優れた複合新素材が登場しました。繊維は衣料材料というイメージを大きく脱し、旅客機のボーイング777の構造材料や航空宇宙、スポーツ用品、土木建築、一般工業製品などに幅広く利用されるようになりました。
参考資料:
ウィキペディア・フリー百科事典
「合成繊維(定義、分類、歴史)」、「レーヨン(初期のレーヨン、ビスコース)」、「Edward John Bevan」
「チャールズ・フレデリック・クロス」、「銅アンモニアレーヨン(歴史、製法)」
「ナイロン(語源、歴史)」、「ウォーレス・カロザース」、「アクリル繊維(概要)」
「ポリエステル(概要)」、「炭素繊維(特徴、歴史)」
ヨハン・ウルバン(https://www.asianprofile.wiki/Johann_Urdan)
コトバンク(https://kotobank.jp/word/化学繊維-43327)「化学繊維の解説」
コトバンク(https://kotobank.jp/word/化学繊維工業-43328)「化学繊維工業の解説」
エコバックハウス(https://ecobag-house.com/blog/q-and-a/2377)「ポリエステルの歴史」
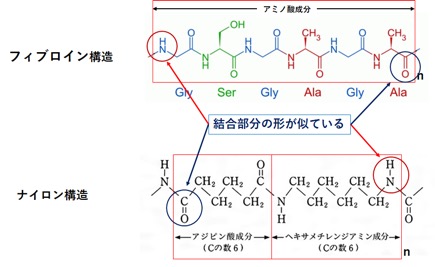
参考資料:
ウィキペディア・フリー百科事典
「合成樹脂(概説、名称、合成樹脂の化学、歴史、用途)」「シェラック(概要)」
「クロロエチレン(歴史)」「ポリ塩化ビニル」「ユストゥス・フォン・リービッヒ」
「アンリ・ヴィクトル・ルニョー」「BFグッドリッチ社」「ユニオンカーバイド社」
「セルロイド(歴史、特徴)」「アレクサンダー・パークス」「Michael Phelan」
「ジョン・ウェズリー・ハイアット」「フェノール樹脂(ベークライトの発明)」
「レオ・ヘンドリック・ベークランド」「アセチルセルロース」「ポール・シュッツェンベルガー」
「エドゥアルト・サイモン」
樹脂プラスチック材料協会ホームページ(https://www.jushiplastic.com/polyvinyl-chloride)
日本ポリスチレン工業会ホームページ(https:/www.jsia.jp/polystyrene/)「ポリスチレンの歴史について」
プラなし生活ホームページ(https://lessplasticlife.com/plastics/facts/history/
2022年7月1日
「化学の泉」投稿文(その6)/豆知識(はじまりシリーズ)
【合成樹脂の歴史】
合成樹脂は一般的には石油を原料とするモノマーを重合してできたポリマーに添加剤を加えた物質の総称です。合成樹脂は、主に原油を蒸留して得られるナフサを原料として製造され、この製造は石油産業の重要な一部門になっています。
そもそも「プラスチック(plastic)」という言葉は、ギリシャ語で「形づくる」という意味の“plassein”に由来し、熱や力を加えて自由に形づくることができるもの、つまり「可塑性物質(plasticisers)」を意味しています。主に金属結晶の分野で用いられた概念を基盤としており、「合成樹脂」と同様に日本語ではいささか曖昧な表現となっています。「プラスチック」が合成樹脂と同義である場合や、合成樹脂が「プラスチック」と「エラストマー(ゴム弾性を持つ素材・材料)」という2つに分類される場合、また、原料である合成樹脂が成形され硬化した完成品を「プラスチック」と呼ぶ場合などと多様な意味に用いられています。よって、英語の文献の「plastic」は厳密性を欠いた全く通用しない用語であるために、一般的には「resin(樹脂)」などと明確に表現する必要があります。
現在では「プラスチック」というと一般に可塑性の高分子化合物を指します。プラスチックは、熱を加えたときの性質によって、大きく2つのタイプに分けることができます。ひとつは「熱可塑性樹脂」で、ガラス転移温度または融点まで加熱することによって軟らかくなり、目的の形に成形できる樹脂です。融かして自由に形をつくることができるため、加工方法によってさまざまな製品に応用することが出来ます。もうひとつは「熱硬化性樹脂」で、加熱すると重合を起こして網目構造を形成し、硬化して元に戻らなくなる樹脂です。耐熱性に優れることから、調理器具や電化製品等に使われています。
プラスチックが誕生する前は、「シュラック」と呼ばれるアカシヤの木に寄生する昆虫(ラックカイガラムシ)から抽出された天然樹脂の一種が、レコード盤の工業材料に使われていました。さて、本題のプラスチック工業の歴史は19世紀にさかのぼります。
1835年に「農芸化学の父」と呼ばれたドイツ人化学者ユストゥス・フォン・リービッヒと教え子のフランス人化学者アンリ・ヴィクトル・ルニョーがジクロロエタンを水酸化カリウムのエタノール溶液で処理してポリ塩化ビニルのモノマーであるクロロエチレン(塩化ビニル)を生成しました。教え子のルニョーが、塩化ビニルのガスを太陽光にあててポリ塩化ビニルの白い個体を作ったのが、最初の合成樹脂と言われています。後に太陽光によるラジカル反応によって塩化ビニルモノマーが重合して、透明で硬くて脆い結晶性の熱可塑性樹脂であるポリ塩化ビニルが生成したことが解明されると、1926年、米国のBFグッドリッチ社が、様々な添加剤を混ぜ合わせることで柔軟性があり加工しやすいポリ塩化ビニルの合成に成功し、翌年には米国のユニオンカーバイド社が初めて工業化したことから化学工業の始まりともいわれています。
1856年、イギリス人発明家アレクサンダー・パークスが綿から取り出したセルロースを硝酸と種々の溶媒で処理し、溶媒を蒸発させて熱可塑性樹脂のセルロイドを発明して特許を取得し「パークシン」の名前で商品化しましたがコストの問題で失敗しました。当時、米国ではビリヤードが流行していましたが、球の材料となる象牙がアフリカゾウの乱獲で不足し非常に高価だったため、1863年に米国人のビリヤードサロンのオーナーで「米国ビリヤードの父」と呼ばれたマイケル・フェランが1万ドルの懸賞金をかけて、象牙に代わる材料の開発方法を募集しました。1869年、米国人発明家ジョン・ウェズリー・ハイアットがパークスの発明したパークシンを研究して、硝酸と硫酸の混合物を使用して製造工程を簡素化し、セルロースを固体で安定したニトロセルロースに変換して、クスノキからとった樟脳を可塑剤として混ぜることにより、加熱すると自由に形をつくることができ、冷やすと固まって割れにくくなる樹脂を開発しました。「セルロイド」の名前で商標登録し製造特許を取得してビリヤードの球の原料として実用化に成功しました。ところが、同じ化合物の特許を取得していたために、後に特許紛争になりましたが、最終的な決定は「セルロイドの真の発明者はパークスであるが、セルロイドの製造はハイアットの会社を含む全てで継続できる」というものでした。セルロイドはビリヤードの球としては弾力性が足りなかったものの、成形性や着色性に優れることから、おもちゃ、文房具、写真フィルムなどの材料として普及し大量に使用されましたが非常に燃えやすく、自己反応性による発火で火災事故が多発したことを受け、1955年アメリカで可燃物質規制法が成立し、市場からの排除運動が世界的に広がり次第に使用されなくなりました。
1869年、フランス人化学者ポール・シュッツェンベルガーがセルロースと無水酢酸からセルロイドの弱点である可燃性を改善した酢酸セルロースを発明しました。1905年にドイツのBayer社で写真フィルム用に工業化したことで映画館の火災が大幅に減少しました。
1872年にドイツ人発明家バイエルがフェノールとホルマリンの反応によって生成するフェノール樹脂を発明しました。1907年、ベルギー生まれで「プラスチックの父」と呼ばれる米国人化学者レオ・ヘンドリック・ベークランドが「ベークライト(商品名)」の合成に成功して特許を取得しました。ベークライトは熱硬化性のフェノール樹脂です。セルロイドは植物のセルロースを原料とするために半合成樹脂と呼ばれますが、ベークライトは完全に人工的な合成樹脂でした。セルロイドは形づくった後も熱が加えられると軟らかくなってしまうなど、いくつかの欠点がありました。そこで熱に強いプラスチックの開発に取り組んだのがベークランドで、大学を卒業した後に生まれ故郷のベルギーからアメリカに渡り、電気絶縁材料の研究をし、石炭から得られるフェノールとホルムアルデヒドの反応時の圧力と温度を制御することで合成できるベークライトが、熱を加えると固まって、その後再び加熱しても軟らかくならないことを発見し、1909年に工業化しました。ベークライトは耐熱性に優れていたことから、19世紀の後期に発明された電話、電灯、ラジオ等の電子部品、そして、さらに食器や灰皿等の日用品として、広く用いられました。
1839年にドイツ人発明家エドゥアルト・サイモンが天然のエゴノキの樹液から抽出される蘇合香(そごうこう)の成分としてスチレンを偶然に発見しました。1922年に「高分子化学の創業者」と呼ばれるドイツ人化学者ヘルマン・シュタウディンガーがスチレン分子の長い鎖状となった構造のポリスチレンを発見し、高分子や重合の概念を提唱し、1928年に合成に成功しました。そして1930年にはドイツや米国で工業化されました。
1920年にユリア樹脂がドイツで発明され、オーストリアで工業化されました。1934年にドイツでガラスのような高い透明性と耐久性・耐候性持ったアクリル樹脂が工業化され、戦闘機の風防に軍事利用されました。1938年、米国のデュポン社の研究員カザロースの研究チームがポリアミド(商品名ナイロン)の合成に成功して工業化しました。
第二次世界大戦後の1945年以降、軍用品として利用されていたプラスチックが一般の市民生活に登場しました。石油化学工業が発達した1955年以降は、コンビナートで原油から直接にポリエチレンやポリプロピレンなどの樹脂が大量に生産され、日用品や衣料品などの生活用品へと利用されました。1970年代には工業用部品として使用可能なエンジニアリングプラスチックが開発され、1980年代にはさらに高度なスーパーエンジニアリングプラスチックが使用されるようになりました。これらの合成樹脂は金属に代わる新たな素材として注目されています。プラスチックは、金属や陶磁器、ガラス等に比べて、一般に軽く、割れにくく、また錆びたり腐ったりしない上に、電気絶縁性に優れ、加工しやすい等の特徴を持つことから、台所用品や家電製品、自動車など、私たちの生活のいたるところで使われています。
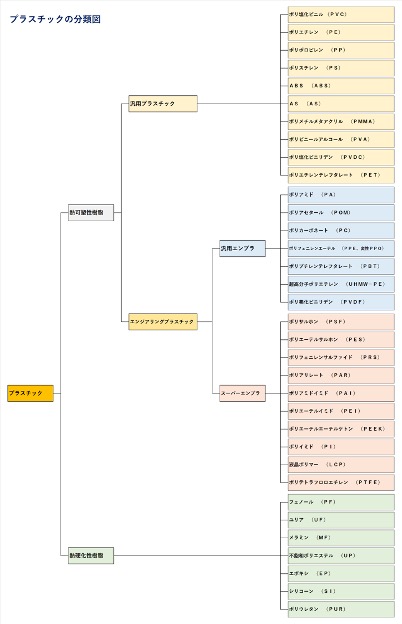
参考資料:
ウィキペディア・フリー百科事典
「合成樹脂(概説、名称、合成樹脂の化学、歴史、用途)」「シェラック(概要)」
「クロロエチレン(歴史)」「ポリ塩化ビニル」「ユストゥス・フォン・リービッヒ」
「アンリ・ヴィクトル・ルニョー」「BFグッドリッチ社」「ユニオンカーバイド社」
「セルロイド(歴史、特徴)」「アレクサンダー・パークス」「Michael Phelan」
「ジョン・ウェズリー・ハイアット」「フェノール樹脂(ベークライトの発明)」
「レオ・ヘンドリック・ベークランド」「アセチルセルロース」「ポール・シュッツェンベルガー」
「エドゥアルト・サイモン」
樹脂プラスチック材料協会ホームページ(https://www.jushiplastic.com/polyvinyl-chloride)
日本ポリスチレン工業会ホームページ(https:/www.jsia.jp/polystyrene/)「ポリスチレンの歴史について」
プラなし生活ホームページ(https://lessplasticlife.com/plastics/facts/history/
2022年6月1日
「化学の泉」投稿文(その5)/豆知識(はじまりシリーズ)
【石油化学の歴史】
石油の起源は14世紀のルネッサンス期ヨーロッパの頃から、生物由来説と非生物由来説の2つに分かれて論争されてきました。しかし、今日の分析化学技術の進歩により、大部分の石油中には光合成生物の葉緑体に由来するポルフィリン、細胞の中に細胞核を持つ真核生物が生産する多環脂質に由来するステラン、細菌が生産する多環脂質に由来するホパン、酵素が関与しない化学反応では生成が困難な光学活性をもつ有機物化合物などのバイオマーカーが含まれていることが確認され、メタンのような炭素数の少ない炭化水素の重合によって生成した非生物由来の石油もわずかながら存在が認められるものの全体からすると極めて少量と推定されることから、論争の主流は生物由来説が広く受け入れられています。
植物由来説では、百万年以上の長期間にわたって厚い土砂の堆積層に埋没した植物や藻類などの生物遺骸が、地殻変動や造山運動などによる地圧や地熱の影響を受けて油母(ケロジェン)に変わり、次いで液体やガスの炭化水素へと変化し、これらが岩盤内の隙間に移動し、貯留層と呼ばれる砂岩や石灰岩などの多孔質岩石に捕捉されて油田が形成されたと考えられています。
地下から湧く燃える水の存在は、古代から各地で知られていました。たとえば、世界最古の石油製品は石器時代には既に接着剤として利用された天然アスファルトがあります。地下から自然にしみ出した天然アスファルトを使って木や竹の棒に接着された、石器時代の矢じりが世界各地で発見されています。4世紀には中国で石油の採掘が行われたという記録があります。8世紀のビザンティン帝国にはギリシャ火薬と呼ばれる石油を原料とした火炎放射器、あるいは焼夷弾に似た兵器がありました。しかし、未精製の石油は燃焼時などに発生する有毒ガスの危険性から多くの国で利用が禁止されたこともあり、積極的な実用化には至りませんでした。
1855年、先住民族のアメリカインディアンが薬用にしていた石油を精製したところ、鯨油よりも照明に適していることが分かり、アメリカの油田開発がスタートしました。石油の照明燃料としての需要が伸びるにつれ、原油採掘の必要性が高まり機械掘りの油田が出現しました。1859年、アメリカの実業家エドウィン・ローレンタイン・ドレークがペンシルベニア州タイタスビルの石油鉱床で機械を使って地中深くの石油を掘り出すのに成功したことがきっかけです。1863年、アメリカの実業家ジョン・デイヴィソン・ロックフェラーがオハイオ州で石油精製業に乗り出し、スタンダード・オイル社を設立しましたがガソリン需要の高まりで、巨大化して市場を独占したために、1911年、最高裁判所の命令で解体され37の新会社に分割されました。この分割された新会社であるガルフ、モービル、シェブロン、エクソン、テキサコなどはそれぞれ旧7大石油メジャー会社の前身として、その名前を連ねました。
当初は、もっぱら灯油が石油ランプの燃料として使われていたため、石油から灯油を採った後に残るガソリンは廃棄されていました。1859年フランスの技術者ジャン=ジョゼフ・エティエンヌ・ルノアールが石炭ガスで動作する内燃機関2ストローク・エンジンを発明し、1876年ドイツの発明家ニコラス・オットーが4ストローク・エンジンを発明しました。これらの内燃機関技術を改良して、1883年ドイツの技術者ゴットリーブ・ヴィルヘルム・ダイムラーが液体燃料であるガソリンを用いた内燃機関を発明し、1886年ドイツの自動車技術者カール・フリードリヒ・ベンツがガソリン動力の自動車を発明しました。これらの技術革新によりエンジンが自動車や飛行機の動力源となりました。自動車の商業実用化が進み、ヨーロッパ各国やアメリカで普及していくにつれて、その燃料となるガソリンの需要が急速に増えていきました。
しかし、油田の発見は困難であり、大量生産できる油田は少なく、米国、ソ連、ベネズエラ、インドネシアと地理的に偏ったため、さらに第一次・第二次世界大戦で軍艦、戦車、軍用飛行機などの燃料でもあったことから石油は戦略資源となりました。第二次世界大戦後、石油の新たな用途として、化学繊維やプラスチックがあらゆる工業製品の素材として利用されるようになりました。さらに、火力発電所の燃料にも利用されるようになり、石油の需要がますます拡大しました。
油田の探査には莫大な費用と高い技術が必要なために、石油産業では企業の巨大化が進み、石油メジャーと言われる巨大な多国籍企業が誕生し、大量産出によって安価になった石油はエネルギー源の主力となりエネルギー革命をもたらしました。
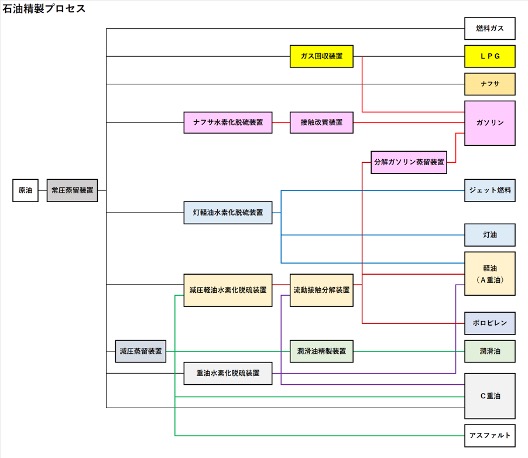
地下から採取されたままの状態のものを特に「原油」と呼びます。原油の成分のほとんどは炭化水素で、いろいろな炭化水素の混合物から構成されていますが、その他に硫黄化合物、窒素化合物、金属類も含まれているため、原油に熱を加えて蒸発させ、その蒸気を冷やして液体に戻す蒸留工程で沸点の差を利用して分留、精製することにより、工業的に有用な石油ガス、ガソリン(ナフサ)、灯油、軽油、重油、潤滑油、アスファルトなどの「石油製品」が得られます。
石油ガスはタクシーやガスレンジの燃料に、ガソリン(ナフサ)は自動車の燃料やプラスチック・合成繊維などの石油化学製品の原料に、灯油は石油ストーブやジェット機の燃料に、軽油はトラックやバスの燃料に、重油は船や火力発電所の燃料に、そしてアスファルトはおもに道路の舗装などに使用しています。
しかし、原油を蒸留して得られる各石油製品の割合はほぼ一定であり、ガソリンは全体の約25%程度に過ぎません。1913年、アメリカのスタンダード石油会社の技術者ウィリアム・メアリム・バートンは、原油の重油留分を熱分解する「熱分解法」の工業化に成功しました。さらに1927年、フランスの機械技師ウジェーヌ・ジュール・フードリーが、石油精製の際の分解蒸留の触媒に活性白土が有効であることを発見し、1937年にアメリカのサンオイル石油会社の協力を得て「接触分解法」の工業化に成功しました。石油精製の重油留分を「熱分解法」または「接触分解法」で低沸点の炭化水素に変換して「分解ガソリン」を製造することでガソリンの収率が50%以上に上がり、さらに多くのガソリンをつくることが可能となりました。その後、原油を蒸留して得られたガソリン留分のオクタン価(エンジン内で自己着火しにくさ、ノッキングの起こりにくさを示す数値)を触媒反応で高める「接触改質法」や、水素の働きによって原油に含まれている不純物を取り除きながら接触分解する「水素化分解法」など、次々に新しい精製技術が開発されて行き、産業構造やライフスタイルとともに移り変わる、各石油製品の需要の変化に対応しています。
参考資料:
ウィキペディア・フリー百科事典
「石油化学(概要、歴史、)」、「石油(概要、起源、歴史)」、「ポルフィリン」、「ステラン」、「ホパン」
「ジョン・ロックフェラー」、「ジャン=ジョゼフ・エティエンヌ・ルノアール」、
「ニコラス・オットー」、「ゴットリーブ・ダイムラー」、「カール・ベンツ」、
「石油精製(蒸留分離、分離装置)」、「クラッキング(化学)」、「活性白土」、「Eugene Houdry」
日本化学工業協会ホームページ(https://www.nikkakyo.org/upload/plcenter/349_371.pdf)
コトバンク(https://kotobank.jp/word/石油化学-86960)「石油化学の解説」
コトバンク(https://kotobank.jp/word/ドレーク%28Edwin%20Drake%29-1571195)「Edwin Laurentine Drake」
コトバンク(https://kotobank.jp/word/分解ガソリン-377175)「分解ガソリンの解説」
2022年5月1日
「化学の泉」投稿文(その4)/豆知識(はじまりシリーズ)
【石炭化学の歴史】
石炭は「黒いダイヤモンド」と呼ばれ、特に産業革命以降20世紀初頭まで最重要の燃料として、また化学工業や都市ガスの原料として使われてきました。
石炭は太古の植物が湖底や海底に層状に堆積し完全に腐敗分解する前に地中に埋もれ、地殻変動や造山運動などによる地圧や地熱の影響を長時間受けて石炭化したことにより生成しました。植物の細胞壁や細胞繊維、木質の主成分であるセルロースやリグニンを構成する元素は炭素、酸素、水素です。石炭化が進むに従って酸素や水素が減って炭素濃度が上がってゆき、外観が褐色から黒色に変わり、硬くなります。化学的には植物生体由来の脂肪族炭化水素が脱水反応により「泥炭」から「褐炭」になり、次に脱炭酸反応により「瀝青炭」となり、最後に脱メタン反応により芳香族炭化水素主体の「無煙炭」に変化します。だから、地中に埋もれた植物は年代を経るに従って「泥炭→褐炭→瀝青炭→無煙炭」へと変成します。
石炭は燃料として、古代に発見され、燃えるということは知られていました。紀元前300年の古代ギリシャでは薪の代用燃料として石炭が鍛冶屋の燃料として使われていたことを「植物学の祖」として知られるテオプラストスが記録しています。
18世紀のイギリスで産業革命がはじまると製鉄業をはじめとした工業が大規模化することで燃料の消費量が増え、薪や木炭に使用する木材が不足したために森林資源の回復が追い付かなくなるのではとの懸念から工業用燃料として石炭が注目され、盛んに利用されるようになりました。その後、スコットランドの機械技術者ジェームズ・ワットによって蒸気機関が実用化され、良質な鉄が安価に大量に生産できるようになり、産業革命を大きく推進しましたが、石炭は工場の動力のほか、鉄道や船の蒸気機関の燃料として用いられ、産業革命の成功の大きな要因となりました。
石炭は本質的に炭素の塊であるために燃料としての利用がもっぱらで、このことは現代でも変わりませんが、工業と化学の進化に伴い化学的に物質として石炭が解明されることにより乾留、ガス化、水素分解、酸化分解などの加工技術が進歩し、都市ガスや各種化学工業の原料として、次第にその用途が広がりました。1709年、イギリス人の製鉄業者エイブラハム・ダービーが石炭を高温で蒸し焼きにする乾留工程でコークス精錬法を発明しました。石炭ガスは1600年代に発見されていましたが、200年後の1792年にスコットランドの機械技術者ウィリアム・マードックによって石炭ガスを利用したガス灯が開発され、照明用のガスとして実用化されました。19世紀の霧のロンドンを照らしたのはこのガスでした。さらに、コールタールの蒸留によって各成分が単離され、1825年コールタール蒸留物のクレオソート油が鉄道の枕木の防腐剤に使用されました。1842年にタールピッチが練炭に使用されました。1845年にドイツ人の化学者アウグスト・ヴィルヘルム・フォン・ホフマンがコールタールの蒸留物からベンゼンを抽出、1856年にイギリス人の化学者ウィリアム・ヘンリー・パーキンが最初のコールタール染料であるアニリン染料を合成、1868年にドイツ人の化学者カール・グレーベが天然染料と同じアリザリンの合成に成功しコールタールが重要な化学工業原料となりました。さらに1907年に米国人の化学者レオ・ヘンドリック・ベークライトがフェノール樹脂を合成して合成樹脂工業の扉を開きました。また、ベンゼンやトルエンが発見され化学の進展に大きな役割を果たしました。ベンゼンなどの芳香族化合物は人工色素などの化学製品、初期化学工業の主要な製品の原料になりました。またコークスは製鉄における鉱石の還元剤に利用されました。さらに、都市の照明や暖房・調理用に石炭由来の合成ガスが使われました。これは石炭の熱分解から得られたガスで、コークスを作る際に発生するメタンや水素を主成分とするコークス炉ガスがロンドンのガス灯などに使われました。次にもっと大量に生産できる都市ガスが開発されました。灼熱したコークスに水をかけて得られる一酸化炭素と水素からなるガスで、大都市で1970年代まで使用されました。便利でしたが毒性が強く、現代では毒性が弱い天然ガスに切り替わりました。1921年にポーランド人の化学者フリードリッヒ・ベルギウスによって石炭の液化法「ベルギウス法」が開発されました。ベルギウス法は高温高圧下で褐炭を水素化することで合成燃料として液体炭化水素を生産する方法です。その後、ドイツや日本など油田が確保できない先進国で盛んに研究されました。特に日本の南満州鉄道や帝国海軍での研究が知られています。
20世紀にはいると石油の採掘技術が発展し、アメリカ国内、中東、インドネシアで大規模な油田が開発され、大量に安価に入手できるようになりました。石油は液体なので貯蔵・移送が便利で、石炭に比べて発熱量が大きく、煤煙が少ないので石炭に代わる燃料として使われるようになりました。1920年、米国スタンダード・オイル社がプロピレンからイソプロパノールを合成して石油化学の先駆けとなり、その後ベンゼンやトルエンが蒸留や精留によって得られるようになると、20世紀中頃にはしだいに化学原料の主流も石炭から石油に移っていきました。ところが石油の可採年数が有限であることが認識されるにつれ、石炭の液化がふたたび注目されるようになりました。しかし、石炭は石油や天然ガスと比べると、燃焼の際のCO2や硫黄酸化物(SOX)などの有害物質の排出量が多く、地球温暖化や大気汚染の主な原因の一つとなるために、石炭の利用は控えられる傾向にあります。それでも、石炭は今後も天然に存在する純度の高い炭素源として一定の価値を持ち続けるものと考えられます。
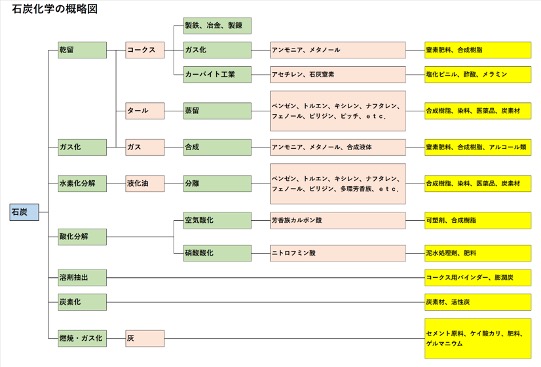
参考資料:
ウィキペディア・フリー百科事典
「石炭(概要、起源、種類、産業分野の利用、利用の歴史)」、「泥炭」、「褐炭」、「瀝青炭」、「無煙炭」、「石炭化学(概要、歴史)」、「コークス」、「コールタール」、「テオプラストス」、「ジェームズ・ワット」、「エイブラハム・ダービー」、「合成ガス(石炭ガス)」、「ウィリアム・マードック」、「アウグスト・ヴィルヘルム・フォン・ホフマン」、「ウィリアム・ヘンリー・パーキン」、「カール・グレーベ」、「レオ・ヘンドリック・ベークライト」、「都市ガス(概要)」、「フリードリッヒ・ベルギウス」、「ベルギウス法」
コトバンク(https://kotobank.jp/word/石炭-86859)「石炭の解説」
コトバンク(https://kotobank.jp/word/コークス-64066)「コークスの解説」
コトバンク(https://kotobank.jp/word/コールタール-66671)「コールタールの解説」
コトバンク(https://kotobank.jp/word/石炭ガス-86861)「石炭ガスの解説」
2022年4月1日
「化学の泉」投稿文(その3)/豆知識(はじまりシリーズ)
【硫酸工業の歴史】
硫酸工業は硫黄を含む無機化合物である亜硫酸、硫酸とその塩を製造する化学工業です。硫酸は日常生活において、すべての分野で直接または間接的にかかわっているといっても過言ではありません。
古代ギリシャの哲学者アリストテレスの「万物は4元素から構成されている。」という物質観は、中世イスラム世界の錬金術師たちに大きな影響をもたらし、真鍮から金に、水銀から銀にと、劣位の金属を化学的手段で精錬し高位の金属に変成させる試みが盛んにおこなわれていました。金属の化学的変成に必要な強い酸化剤が求められる中、8世紀後半、アッバ-ス朝イスラム帝国の錬金術師ジャービル・イブン・ハイヤーンが硫酸の精製法を発明しました。彼は他にも現代化学工業の基礎になる、塩酸、硝酸、王水などの精製法や、ガラス器具の蒸留装置アランビックも発明しています。
純粋な硫酸は水蒸気と親和性が高いため自然界には存在しません。そのため、ミョウバン(明礬)、緑礬(りょくばん)、胆礬(たんばん)など硫酸塩の鉱石を乾留して硫酸を作りました。ミョウバン[AlK(SO4)2・12H2O]は硫酸カリウムアルミニウムの12水和物、緑礬[FeSO4•7H2O]は硫酸鉄の7水和物、胆礬[CuSO4•5H2O]は硫酸銅の5水和物です。いずれにせよ乾留過程で熱分解によって酸化鉄あるいは酸化銅など酸化金属とともに三酸化硫黄[SO3]が生じ、これが水を吸って凝縮して希硫酸が得られました。
12世紀にはイスラム錬金術がラテン語訳されてヨーロッパで盛んに研究されるようになり、この方法がイスラム文献の翻訳で中世ヨーロッパに伝えられました。
硫酸製造の工業化は鉛室法の開発の歴史でした。14世紀、ドイツ人でカトリック教会最古の修道会であるベネディクト会の修道士であり、錬金術学者でもあったバシリウス・ヴァレンティヌスが、硫黄と硝石(硝酸カリウム)を併せて燃焼させると希硫酸が生成することを発見しました。17世紀、オランダ人の発明家コルネリウス・ドレベルが、加熱した硫黄と硝石から効率よく硫酸を回収する方法を確立しました。1648年、ドイツ人の薬剤師であり化学者のヨハン・ルドルフ・グラウバーは医薬品製造業を立ち上げ、硝石と高濃度の硫酸を加熱して硝酸を製造するためにアムステルダムに硫酸工場を設立しました。水蒸気を通しながら硫黄と硝石を併せて燃やし、硝石の分解生成物が硫黄を酸化して三酸化硫黄を作り、三酸化硫黄と水の化合物として硫酸を製造しました。1654年には食塩に硫酸を反応させる塩酸の精製法も開発しています。1736年にはイギリス人のジョシュア・ウォードが、全工程にガラス容器を用い、グラウバーの製法で生産規模を拡大しました。1746年、イギリス人の化学技術者ジョン・ローバックが反応容器の素材をガラスから硫酸に侵されなくて安価な鉛に変更することで、鉛室法の基礎が確立されました。硫酸の製造コストが大幅に引き下げられたことで鉛室法の工場がイギリス中に広がりました。スコットランドの亜麻繊維(リンネ)の漂白剤の製造に硫酸が欠かせないことから、17世紀から18世紀の産業革命の進展に大いに寄与しました。最終的に1793年、フランス人の化学者ニコラ・クレマンとシャルル・デゾルムが鉛の反応容器の中で空気を通じながら硫黄と硝石を燃焼させることで、鉛室法が完成しました。その後、鉛室の前段階で硫黄を燃焼し、三酸化硫黄を製造する工程が開発されました。
1827年、フランス人の化学者ゲイ・リュサックは、鉛室で生成した窒素酸化物を回収するため鉛室の後段に接続するゲイ・リュサック塔を考案しましたが、硫酸工場に設置されることはありませんでした。1859年にイギリス人のジョン・グローバーが、回収した不純物を含む硫酸から硝酸を分離するためのグローバー塔を考案しました。その後、グローバー塔とゲイ・リュサック塔を組み合わせ、2つの塔の間に数個の鉛室を配置し、生成した硫酸と亜硝酸の混合酸無水物である硫酸水素ニトロシル[NOHSO4]が加水分解されて、亜硝酸と硫酸を生成する「硝酸式」が開発されました。ゲイ・リュサック塔はグローバー塔と組み合わせることで真価を発揮しました。
硫黄の燃焼室、グローバー塔、鉛室、ゲイ・リュサック塔を直列に接続し、グローバー塔とゲイ・リュサック塔の間で硫酸を循環させるシステムができあがり、これをもって、硝酸式硫酸製造法が完成され、1870年代には硝酸式硫酸工場がイギリスを中心にヨーロッパ中に広まりました。
その後、高濃度の硫酸を製造するために白金触媒を用いる「接触法」が開発されました。この白金触媒は硫黄原料中に含まれるヒ素の不純物と反応しやすいため、1915年に五酸化バナジウム触媒を用いた「BASF法」に置き換わっていきました。より高品質の硫酸が得られる接触法の登場で鉛室法は廃れてしまいました。
硫酸は化学工業における重要な物質で肥料製造に最もよく使われ、鉱物処理、石油精製、排水処理、化学合成などにも使われています。その用途は酸性排水処理剤、鉛電池の電解質、化合物の脱水、各種洗浄剤など多岐にわたります。今日、硫酸の生産量はその国の工業力を示す指標となっています。
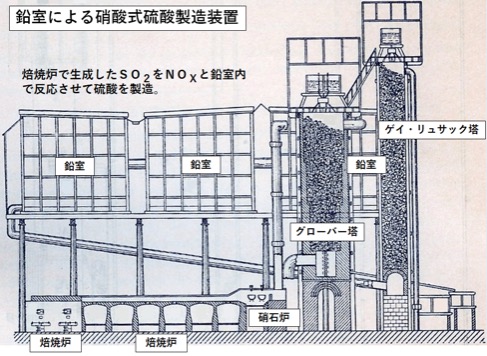
参考資料:
硫酸協会ホームページ(https://ryusan-kyokai.org/dic/dic.html)
コトバンク(https://kotobank.jp/word/硫酸-149622)「硫酸の解説」
ウィキペディア・フリー百科事典
「化学工業(概要)」、「硫酸(概要、歴史)」、「錬金術(歴史、思想)」、「ミョウバン(概要)」
「緑礬(概要)」、「胆礬(概況)」「ジャービル・イブン・ハイヤーン(生涯、業績)」
「アランビック(概要)」、「鉛室法(歴史)」、「Basilius Valentinus」、「ジョン・ローバック(略歴)」
「ゲイ・リュサック(業績)」「硫酸水素ニトロシル(概要)」、「接触法(概要)」
2022年3月2日
「化学の泉」投稿文(その2)/豆知識(はじまりシリーズ)
【アンモニア工業の歴史】
アンモニア工業は窒素肥料(アンモニア)や火薬(硝酸)など窒素を含む無機化合物を製造する化学工業です。
アンモニアの名前の由来は古代ラテン語の「Sal Ammoniacum (アモンの塩)」が語源と言われ、エジプトのアモン神殿の近くから塩化アンモニウムが産出したことにちなみます。1774年、「酸素」の命名で知られるイギリスの自然哲学者ジョゼフ・ブリーストリーが気体の研究をしていた時、食塩と尿から塩化アンモニウムを合成する過程でアンモニアを発見しました。
窒素は植物の育成に必要不可欠な栄養素の一つです。同じ土地で農作を繰り返すと、土壌の窒素が減ってくるため、植物は十分な栄養を吸収することが出来なくなり生育不足に陥ります。古代より肥やし、魚肥、大豆かすなどが自給窒素肥料として使われてきました。化学肥料としての窒素肥料は天然の硝石(硝酸カリウム)です。水に可溶なため乾燥地帯の蒸発した湖底などで採取されました。硝石は土壌中の動物の排泄物や有機物に含まれる尿素などの窒素化合物が亜硝酸菌と硝酸菌の二段階の微生物による酸化を受け、硝酸塩になることで得られます。
硝石は肥料や染料など、製造に窒素が必要な原料として、昔から用いられてきました。特に、酸化剤として黒色火薬の製造に必須の火薬材料で、黒色火薬が唯一の鉄砲用火薬であった時代には、重要な戦略物質でした。フランス革命時代、イギリスとの外交事情で硝石の輸入が困難になったフランスでは、風通しのいい小屋に窒素を含む木の葉や石灰石・糞尿・塵芥を土と混ぜて積み上げ、定期的に尿をかけて硝石を析出させる「硝石丘法」が発明され、ナポレオン戦争の火薬供給に大きな役目を果たしました。
1820年ごろ、チリのアタカマ砂漠において広大なチリ硝石(硝酸ナトリウム)の鉱床が発見され、ヨーロッパに安価なチリ硝石が大量に供給されるようになりました。しかし、18世紀後半からの産業革命によって生活水準が著しく向上した結果、人口が急激に増え続ける中、限りある硝石もいずれは掘り尽くされ、肥料不足から農業生産が低下して、深刻な食糧危機が訪れるのではないかと懸念されるようになりました。さらに、19世紀の後半になると爆薬や火薬の新用途が生まれ硝石の需要はますます高まり、それに代わる窒素化合物を人工的に作り出す方法の開発が強く求められました。
1898年、英国の経済学者ウィリアム・クルックスは、「このままの状態が続くと南アメリカの資源は枯渇し、農産物が収穫できず、世界は食糧不足へと陥るだろう。」と警告し、化学的に固定窒素を合成させることの必要性を説いています。そこで化学者たちは、空気中に大量に存在する窒素を、肥料や火薬として使用することのできる化合物として固定することを試みました。フランスのモアッサンが電気炉内で石灰と炭素からカルシウムカーバイト(CaC2)を合成すると、ドイツのフランクとカロは加熱したカルシウムカーバイドに窒素を反応させることで、石灰窒素(カルシウムシアナミド)が合成できることを発見しました【石灰窒素法】。また、ノルウェーのビルケランドとアイデは空中で火花放電させて窒素と酸素から酸化窒素(NO)を作る空中窒素固定装置を開発して硝酸カルシウムの生産をはじめました【高電圧放電法】。しかし、いずれの方法も空気中の窒素を固体中に固定する方法ではありましたが、電力費が非常にかかったため工業化には不向きでした。
ドイツでは当時、三国軍事同盟(ドイツ、オーストリア、イタリア)を結び三国協商(イギリス、フランス、ロシア)と対立したために、硝石の入手が非常に困難になっていました。ユダヤ系ドイツ人化学者フリッツ・ハーバー(1868~1934年)は、反応条件や触媒を変えて何度も実験を繰り返した結果、1908年に、500℃、200気圧という高温・高圧の条件のもとで、オスミウム触媒を用いて、窒素と水素からアンモニアを合成することに成功しました。ところが、ハーバーの発明した方法にはいくつかの欠点がありました。それを克服したのは、ドイツBASF社の技術者カール・ボッシュ(1874~1940年)ら、ハーバーの研究仲間達です。欠点の一つは、オスミウムが世界にわずかしかない高価なものだということですが、それに代わる、より安価な触媒として、磁性酸化鉄を主成分とする触媒が最適であることを発見しました。もう一つの欠点は、反応が高温・高圧下で行われるため、すぐに装置が壊れてしまうということですが、もともと冶金技術者だったボッシュの経験を活かして、過酷な条件に耐えうる装置をつくりあげ、アンモニアの量産を可能としました【ハーバー・ボッシュ法】。ついに1913年、BASF社ブルンク社長はアンモニア合成の工業化を決断し、20世紀化学工業の幕明けを告げることになりました。
しかし皮肉なことにこの発明は、人間を養うことのできる肥料だけでなく、人間を殺傷することにも使える大量の火薬をドイツにもたらし、1914年から始まった第一次世界大戦において大きな戦力となりました。ドイツ皇帝ウィルヘルム2世はこの発明でアンモニアさえあればドイツは食糧や爆薬が自給できると判断して対戦を決意したともいわれています。愛国心の強いハーバーはさらに、軍の技術指揮官として化学兵器の開発にも協力し、1915年にベルギーのイーブルで彼が指揮した世界初の毒ガス戦では、多くの兵士が命を奪われました。日頃から化学兵器に反対していたハーバーの妻は、これに抗議して自殺してしまいました。さらにハーバーの協力の甲斐なく戦局は悪化して、1918年にドイツは敗戦を迎えました。
戦後の荒れ果てた農地で、ハーバーのアンモニア合成技術はあらためて肥料の製造に役立てられるようになり、世界的にも彼の功績が認められて、1918年にノーベル化学賞が授与されました。ボッシュも、「高圧化学的方法の開発」により1931年にノーベル化学賞を受賞しています。やがて、1933年にドイツにナチス政権が成立し、ユダヤ人の弾圧が始まると、ハーバーはイギリスへ亡命、翌年スイスのバーゼルで病死し、故郷の土を再び踏むことはありませんでした。波乱の生涯を送った彼の名は、「空気からパンをつくった人」として今も歴史に刻まれています。
大規模な工場の建設に基づくアンモニアを直接合成するハーバー・ボッシュ法は世界中のどこでも安価な生産費用で大量生産することが出来ました。この成功により高圧化学の新たな道が開かれ、その後の装置産業によるメタノールの合成や石油化学工業の発展に寄与しました。
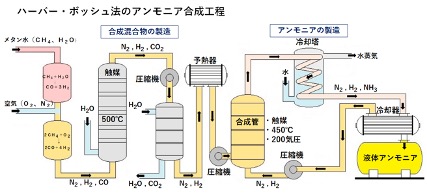 参考資料:
参考資料:
(1)ウィキペディア・フリー百科事典
「化学工業(概要)」、「アンモニア(概要)」、「ジョゼフ・ブリーストリー(生涯)」
「塩化アンモニウム(概要)」、「硝石(製造史)」、「硝酸カリウム(概要、製造)」
「ウィリアム・クルックス(生涯)」「ハーバー・ボッシュ法(概要、歴史、結果)」
「フリッツ・ハーバー(経歴、開発経緯、影響)」、「カール・ボッシュ(生涯、業績、評価)」
(2)化学辞典 第2班 森北出版 「窒素肥料」
2022年2月9日
「化学の泉」投稿文(その1)/豆知識(はじまりシリーズ)
【ソーダ工業の歴史】
ソーダ工業は、基礎産業の一つです。塩を原料に、幅広い産業分野の原料・副原料、反応剤などに使われる化学薬品を製造する工業で、ガラス製品や石鹸の製造から発展しました。
天然ソーダ(炭酸ナトリウム)は水に可溶なため、湖水が蒸発した湖底で自然に採れることがあります。天然ソーダはメソポタミアやエジプトの乾燥した湖で入手できました。紀元前5000年頃、ケイ砂に天然ソーダと石灰を混合して融解するガラスの製造法が発見され、陶磁器や青銅器の装飾材料としてガラス製品が盛んに作られるようになりました。
また、古代ローマでは神殿で羊を焼いて神に捧げる風習がありました。繰り返される神事で、火であぶった肉から滴り落ちた脂肪が加熱した木灰に混ざり、加熱木灰が脂を煮るアルカリ剤の役目を果たしたことで石鹸ができたのです。この石鹸がしみ込んだ土は汚れを落とす不思議な土と珍重され、神殿があった丘の名前を取ってサポー(Sapo)呼ばれました。英語読みでソープ(Soap)です。これが石鹸の語源になりました。このように油脂と木灰を煮詰めたものの洗浄効果が発見され、石鹸の基になりました。後に、ソーダ原料として木灰より海藻の灰が適していることが分かりました。ナトリウムが豊富な海で育った海藻の灰は炭酸カリウムが多く含まれる木材の灰と異なったため、ソーダ灰(炭酸ナトリウム)と呼ばれました。8世紀頃からは、産地である地中海沿岸で海草の灰と油脂を使って工業的に石鹸が作られるようになりました。
18世紀の後半になると、ヨーロッパでは、産業革命によって織物工業が急速な発展を遂げ、織物を製造する工程で、原糸を洗ったり、仕上げの段階で織物についたロウ等の不純物を洗い落としたりするために、石鹸の需要が拡大しました。また石鹸の原料となるソーダは、ガラスの原料としても使われていたため、海草灰や木灰だけでは、急激に増えるソーダの需要を満たすことがさらに困難になりました。特にフランスでは、スペインとの王位継承戦争に敗れたために、スペイン産の天然ソーダが輸入出来なくなり、事態はとても深刻でした。
当時、食塩にソーダの成分が含まれていることは既に周知だったのでフランス化学学士院は、豊富にある海水を利用した食塩から炭酸ナトリウムを作り出す製造方法を高額な賞金を懸けて募集しました。その発明に成功したのがニコラス・ルブラン(1742~1806年)です。オルレアン家(ブルボン朝フランス王家の支流)の私的な侍従医を務めるかたわら化学の研究をしていた彼は、食塩と硫酸から作った硫酸塩を石灰や木炭などとともに炉で焼いた後、それを洗い、水に溶け出した成分を濃縮して、炭酸ソーダの結晶を取り出す方法(ルブラン法)を発明しました。石灰や木炭という安価で手に入れやすい材料でソーダを作ることが出来るようになったことから、ルブラン法を用いたソーダ製造工場が各地に建てられ、ソーダ工業化の第一歩をしるしました。それまで庶民の手には届きにくかった織物、石鹸、ガラスなどの大量生産が可能となり、庶民の間に普及しました。特に石鹸の流通によって、伝染病や皮膚病の発生が大幅に減りました。しかし当のルブランは、フランス革命でパトロンであったオルレアン公を失った上、彼自身の工場と懸賞金を革命政府により没収され、悲憤のうちにピストル自殺するという運命をたどりました。
19世紀の後半になると製鉄業が盛んになり、石炭から製鉄用コークスを生産する際の副産物としてアンモニアが豊富に得られるようになり、そのアンモニアを利用してソーダを作る方法が研究されました。これに成功したのが、ベルギーの化学者エルネスト・ソルベイ(1838~1922年)です。叔父が経営するガス工場で働きながら、ガスの洗浄液からアンモニアガスや炭酸ガス等の成分を回収する研究を行っていた彼は、あるとき、食塩水にアンモニアガスと炭酸ガスを吹き込むと炭酸水素ナトリウム(重曹)が出来ることを発見し、これを焼いてソーダを作る方法(ソルベイ法)を発明しました。この方法は、ルブラン法に比べ低い温度で反応が行われるため燃料が節約できる上、反応の工程で生ずるアンモニアや炭酸ガスを回収して再び利用することにより安価で品質の高いソーダを作ることが出来たので、化学工業が大規模化する中で、ルブラン法に代わってソーダ工業を発展させていきました。
炭酸ナトリウムは「ルブラン法」「ソルベイ法」、そして現在では水酸化ナトリウムと塩素は海水の塩を電気分解する「電解法」で製造されています。時代とともに変遷を遂げながらも、化学の力でソーダを製造するソーダ工業は、さまざまな化学原料の源となり、いろいろな化学製品にすがたを変えて、私たちの身の回りで役立っています。
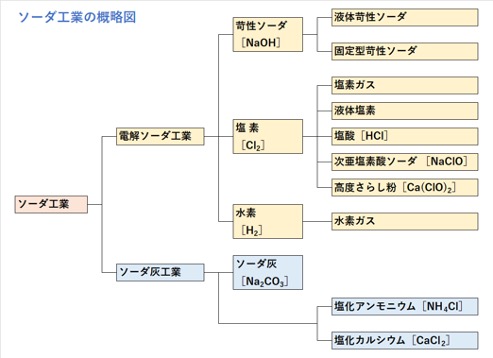 参考資料:
参考資料:
(1)日本化学工業協会ホームページ(https://www.nikkakyo.org/upload/plcenter/349_371.pdf)
(2)日本ソーダ工業会ホームページ(https://www.jsia.gr.jp/history/)
(3)建材ダイジェストホームページ:ガラス作りの歴史(https://kenzai-digest.com/glass-history/)
(4)石鹸百科ホームページ:石鹸の歴史(https://www.live-science.com/honkan/soap/soaphistory01.html)
(5)ウィキペディア・フリー百科事典
「ソーダ工業(歴史)」、「ソーダ石灰ガラス(概要)」、「炭酸ナトリウム(歴史的な製造法)」
「ニコル・ルブラン(生い立ち)」「ルブラン法(背景)(工業的歴史)」、「エルネスト・ソルベイ」
「ソルベイ法(工業的歴史)」
(6)米田幸夫「化学大辞典(縮小版第26版)、共立出版」
2017年12月16日
パリ協定とEV化
備考: 今年を振り返って、表記の課題を設定してみました。進行形の課題ですのでいろいろ意見があると思います。どうぞご意見を寄せてください。来年は表記のこの課題で皆様と情報交換をしたいものです。データ等については、新しいデータが発表されているかもしれません。
水素社会にむけて
表題について会員の皆様に意見、情報等を寄せて頂いています。
これまでに2件の投稿がありました。是非続けての投稿を待っています。
この間、各学会等でも水素について特集を組んだり、シンポジウムが開かれたりしています。ここでは、手に入りました情報を参考までに記しておきます。
① 石油学会、”ペトロテック”No.9、水素社会の到来と石油・石油化学業界 (2015)
② 化学工業会、”化学工学会第47回秋季大会(北大)、世界をリードする日本の水素技術・燃料電池自動車 (2015)
以上
私の街にも「水素」がやってきた
化学の泉で水素社会が取り上げられている。現役を引退して既に長い年月を経た私にとっては難解な問題であるが、頭の体操と思い興味深く、期待して読んでいます。
最近、私の住む街のガソリンスタンドに併設された倉庫風の建屋に「水素ステーション」の文字を見つけた。早速出向き遠くから眺めていると、「見学しますか? 今、計量器の検査・点検作業中ですから内部も見れますよ。パンフレット*)もどうぞ。」と声を掛けられた。パンフレットを有難く戴き、近寄って見学させて貰った。計量器の内部に見慣れた流量計・圧力計等がある。メーカー名(A社)何と私の元所属会社=自動車部品会社である。
記憶は40年前に遡る。ガソリンの成分分析、金属材料への腐食・防食実験、プラスチック材料・ゴム材料の膨潤性・耐熱性・耐寒性、パッキン部品としてのシール性・安定性等々、種々な条件で実験を繰り返してガソリン計量器の機能性や安全性を確かめた若い日を想い起こした。「お客さんの燃料自動車は?水素入れますよ。」「え!もう車走っているの!」「はい、この水素供給機で販売・営業していますよ。」 既に、自動車燃料がガソリンから水素に代わる時代を迎えようとしている。ところで、「水素の安全性については、どうなのか?」。水素を扱う上で最も重要なことは、安全性である。爆発性のある危険なガスだから。勿論、自動車会社や周辺機器・設備会社の技術開発は進んでいる。安全性にも万全の対策・処置がなされている。等々と思う。だが、一般の人達は何も知らずに自動車に乗る。予期せぬ事故も起きるだろう。それでもなお、万全の安全性は確保されなければならない。まだ、記憶に新しい、あの「想定外は許されない」のである。未来も自動車の数は増え続ける社会、自動車燃料として使用される水素の安全性の確保については社会全体が技術面から、経済面から、政治的にも、社会的にもあらゆる視点で深く議論し、合意を形成する必要があるのではなかろうか。
私がパンフレットから勉強して知り得た「水素燃料」の知識です。
(技術的・学問的な正確性は充分ではありません。理解の誤りについてはご指摘をお願い致します。)
*水素燃料は水素トレーラー(45MPa)で輸送される。
(水素ガスを圧縮し、高圧縮ガスとして、体積を縮小、耐圧容器で輸送する。)
*積載容器は炭素繊維複合容器(300L×35本=380kg)に入っている。
(容器は軽量・対圧仕様、水素ガスは危険性のガスであり、現在も容器は鋼鉄製で赤色に識別されている。)
*燃料保管のトレーラー庫や水素トレーラーの安全対策:開閉式屋根構造、ガス検知器、火災検知器、防水設備
*トレーラー庫・水素トレーラ接続ユニットの安全対策:緊急遮断弁、安全弁、遮断防止弁、(水素の過大流量の防止)、逆止弁(水素の逆流を防ぐ)。
*設備:圧縮機の機能と安全設備;処理能力300Nm3,45MPaの水素を82MPaに昇圧する。
その建屋は耐震性に優れ、水素が滞留しない屋根構造。ガス検知器、緊急停止ボタン、換気設備。
*設備:蓄圧器の機能;圧縮機で昇圧した水素は蓄圧器(高圧容器)で貯蔵する。
超高圧の水素を保存するため燃料電池自動車への急速充電が可能となる。
*設備:冷凍機ユニットの機能;燃料電池自動車(FCB)に充填する水素を-33℃まで冷却し、FCV側の水素容器の温度上昇を抑制(ガスは圧縮されると温度が上昇する)。
冷凍機で冷やした冷媒を水素充填機に送り、水素充填機内に設置した熱交換機で蓄圧器から送られてくる水素を冷却しFCVへ充填する。
*設備:デイスペンサー(水素供給装置)の機能と安全対策
燃料電池自動車に水素(70MPa)を充填する。充填料を高精度で計量するため、超高圧対応の小型高精度コリオリ流量計を採用。水素が滞留しないキャノピー構造、車両衝突ガード、緊急停止ボタン、ガス検知器、緊急遮断弁、安全弁、圧力リリーフ弁等の安全対策。
水素ステーションには上記の様な安全対策がなされていることを理解した。
参考パンフレット*) 株式会社ENEOSフロンティア
水素の役割と期待
化学の泉を読ませていただき、自分の考えている水素の役割と期待についてコメントしたいと思います。
水素は、石炭、ガス、石油等多様な1次エネルギーから作られ、輸送貯蔵も可能でありエネルギーの安定供給面で有利性を有し、かつ、エネルギー効率が高く、また、利用時に温室効果ガスの排出が少ないなど低環境負荷である。さらに、定置用燃料電池、燃料電池自動車とも分散型電源あるいは非常時の電源として活用が可能等レジリエンス面でも利点を持つ未来のエネルギーであることに違いない。再生可能エネルギー由来の電気で水素を作ればほとんど温室効果ガスを排出しないことも可能である。政府はこのような特徴に着眼しエネルギー政策面から「安価安定な水素エネルギー供給システム」をめざし技術開発・普及支援を推進しようとしている。
このように水素は低炭素エネルギーとして魅力的ですが、これで3E+S*すべて解決、ということにはならない。
*3E:Energy security, Environment, Economics + Safety
エネルギーというのは経済社会活動の源ですから、大量な量を必要とする。また、製造、輸送、貯蔵、配送、消費というあらゆる面で安価、安全、取扱容易性が求められる。水素はガス体で、液体にすることにより貯蔵・運搬が容易になる。それゆえ、エネルギーの根幹となるためには、水素の製造、貯蔵、輸送という面でまだまだ解決しなければならない課題が多く残されている。例として、ハイブリッド車は、現在では、どこでも見られるほど普及している。1997年に第一世代のハイブリッド車プリウスが発売開始されてから18年たち、車両技術面も改善に改善が重ねられ経済的で(補助はあるが)、環境性能に優れ、運転も快適な車として現在の普及に繋がった。約20年である。水素に関しては燃料電池自動車の技術だけでなく、水素自体の製造、輸送、貯蔵、配送、消費までの持続的バリューチェーンが確立されるためにはまだ多くの改善課題、必要な技術開発とともに法規制等制度面の改善も必要といわれている。マイナス254℃で液化すれば800分の1に、メチルシクロヘキサンとして有機ハイドライドにすれば500分の1で取り扱える。また、80MPaに圧縮しても効率よく利用できる等可能な要素技術は存在する。しかし、水素が文字通り社会に受け入れられるコマーシャルなエネルギーとして活用されるには時間が必要である。将来のサステイナブルなエネルギーとしてその供給の一端を担えるエネルギーとなるには、着実に課題を解決しつつ、低炭素社会に貢献できるエネルギーとして活用することを期待してやまない。
ガス会社の立場から
水素をエネルギー源として利用する表題の水素社会が実現に向け動きだしている状況下で、ガス会社から見た視点で水素に関してお話しさせて頂きたいと思います。水素は、ご存じのように原子番号1で、地球上の一番軽い元素です。従って、ガスの状態では漏れやすく空気中での爆発範囲は4.0%~75.0%(大陽日酸MSDSより)と広く、福島第2原発での水素爆発は記憶に新しい事故だと思います。また、水素は燃焼したときの火炎は見えにくく燃えているかどうかの確認が困難です。ガスクロを使った人はFIDを使用した際、経験していると思います。自動車でガソリン並みに使用するためには相当の圧力で貯蔵しなければならず、漏洩のリスクは高くなります。水素のボンベが赤いのは注意を促しているからです。怖い話ばかりしてきましたが、水素は燃やしても水が出来るだけですから、CO2削減にもなり、まさにクリーンなエネルギーです。
さて、どうすれば水素をうまく利用できるのでしょうか?
水素に限らずガスを使用する基本は、漏らさないことです。貯蔵する際に細心の注意を払い、漏れる可能性を極力減らした容器、貯蔵設備と使用する機器・配管も漏れる個所が少ない設計が必要となります。もし、不幸にして水素が漏洩したとしてもすぐに検知して、災害になる前に漏洩を止めなければなりません。万が一漏洩しても対処が速く適切であれば大惨事にはなりません。
ガスは知らないと取り扱いが難しく、取り扱いたくないと思われがちですが、ガス毎の性質を理解して適切な扱いを行えば、扱いやすい物質です。
これからの、水素社会に向けて、水素の性質、特性をよく理解して扱えば、クリーンで安全なエネルギーとして利用することが出来ると思います。
いろいろとお話ししましたが、まず扱う前にガスを知り、漏らさず、出さず、正しく取り扱うことが基本中の基本です。
「皆さんからの投稿を歓迎します。」
水素社会に向けて
水素を燃料とした車からは、水のみが排出され大変クリーンな環境が保持される。将来は水素社会であるべきだ、等のコメントが新聞やテレビで取り上げられている。しかし、肝心の水素はどうやって作るの?どうやって水素を貯蔵したり輸送するの?等の疑問点には、あまり場合によっては全く触れていないのも現状と思います。
このような中、2014年4月エネルギー基本計画が閣議決定された。この中で水素エネルギーは、将来の重要な二次エネルギーと位置づけられた。また、東京都は東京戦略会議を設置して、2020年の東京オリンピック・パラリンピックでは、水素を活用しようと計画している。そして民間では、千代田化工建設㈱が水素の製造、貯蔵、輸送、使用についてSPERA H2 System を発表している。
そこでこのコーナーでは、将来の水素社会に向けて、製造は、貯蔵は、輸送等はこうあるべき、あってほしい等の意見を会員の皆様よりよせて頂き、会員同士が勉学しあえればと思います。
意見は、記名でも匿名でも良いと思いますが、企業としてのPR,売り込みは遠慮いただきたいと思います。あくまでも個人としての考えでお願いします。
文献:
エネルギー基本計画 2014年4月11日
http://www.enecho.meti.go.jp/category/others/basic_plan/pdf/140411.pdf
東京都HP東京戦略会議
“SPERA”TMシステム 岡田ら、触媒、57(1)8~13(2015)